Teoría de los mionúcleos
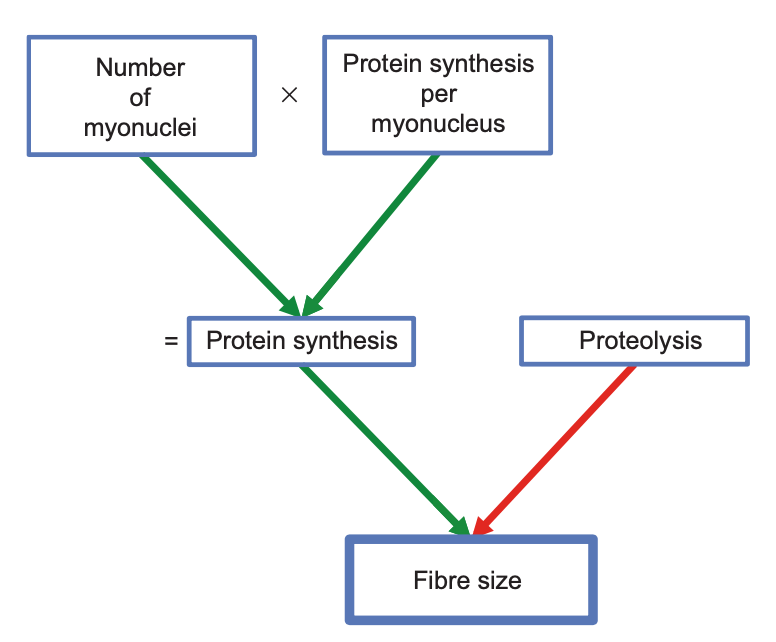
El músculo esquelético está compuesto de un gran número de núcleos (mionúcleos) en los que se da todo el proceso de síntesis de proteínas necesario para el crecimiento muscular. Con el entrenamiento, podemos observar que no solo se pone en marcha la síntesis de proteínas, también puede aumentar el número de mionúcleos —mediante la fusión de células satélite— que tiene como fin aumentar la capacidad de síntesis de proteína total (que viene determinada por la capacidad de síntesis de proteína por núcleo y el número de núcleos existentes).
Algunos han demostrado y defienden que los mionúcleos se mantienen durante un largo período de tiempo o incluso indefinidamente. Lo que nos llevaría a pensar que el número de núcleos aumenta con el entrenamiento y se mantienen, podemos aumentar el número de núcleos eternamente…pero no es así.
Existen dos hipótesis que intentan explicar este límite en la generación de núcleos (Gundersen K., 2016).
“Ceiling hypothesis”: Podemos hipertrofiar sin reclutar nuevos núcleos hasta un límite (aumentos relativos en torno a 17-36% o hasta un volumen determinado de citoplasma por núcleo).
“Peak pegging hypothesis”: A los límites anteriores se le suma el historial de la fibra. Se argumenta que el número de mionúcleos que encontrados en un fibra representa el mayor tamaño muscular que la fibra ha tenido en su historia y que la adicción de nuevos núcleos solo se da si la fibra crece más de este tamaño.
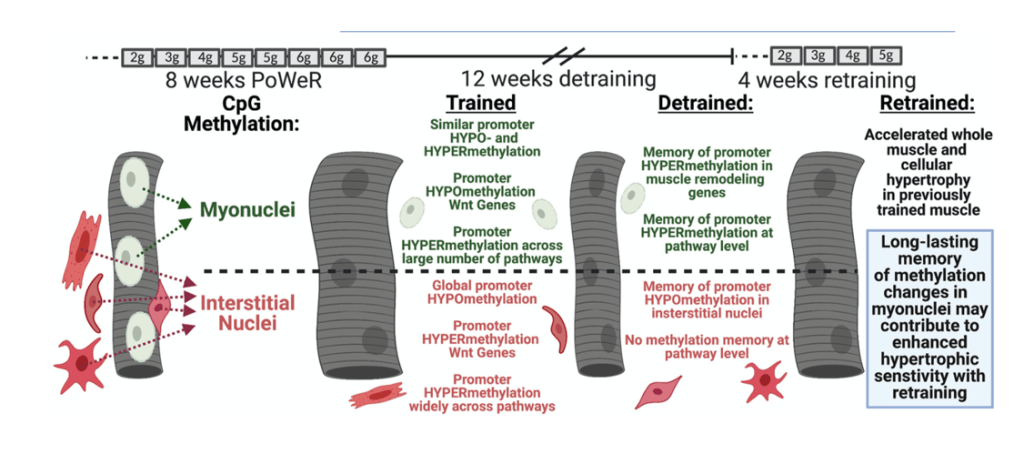
En defensa de esta idea, se ha demostrado (Snijders et al., 2021) que el aumento de tamaño de fibras musculares pequeñas se asocia de manera significativa a un aumento en el tamaño en el dominio de los mionúcleos, pero no a un aumento en el número de mionúcleos. Es decir, como hay crecimiento muscular y la misma cantidad de mionúcleos estos tiene que abarcar una mayor área (mayor dominio). Esto sugiere que los mionúcleos existentes en las fibras musculares pequeñas son capaces de favorecer la hipertrofia sin la necesidad de generar más mionúcleos. Por su parte, el incremento de las fibras muy grandes se asocia al incremento en contenido de mionúcleos (no en el tamaño del dominio de estos). Estos datos, concluyen los investigadores, van en la línea de la “teoría del límite del dominio de mionúcleos”, que defiende que la adición de mionúcleos es un requisito una vez se alcanza un umbral en el tamaño en el dominio de los mionúcleos existentes.
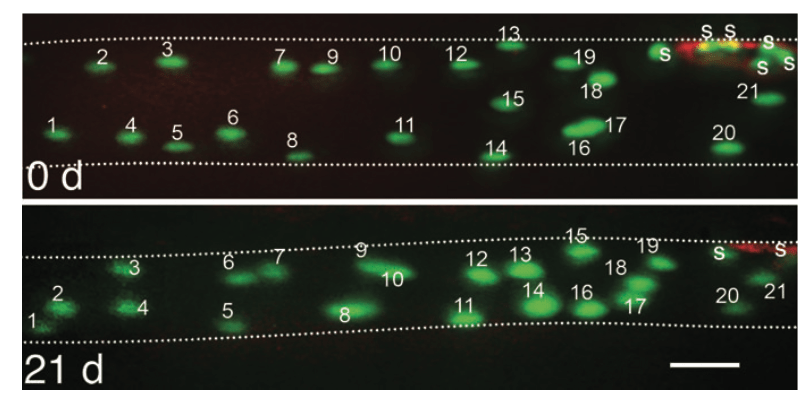
Vemos por tanto, que al menos a partir de cierto momento, con el entrenamiento podemos ir sumando mionúcleos en nuestras fibras musculares y que estos no desaparecen. Al menos a corto plazo. Y existen datos científicos de que los mionúcleos pueden durar entre 15 años y toda la vida, y que no se pierden ni siquiera cuando se produce una atrofia del músculo.
Esto podría tener una justificación a nivel evolutivo. En períodos de baja actividad no nos interesa mucha masa muscular, pero tenemos que tener la capacidad de recuperarla cuando sea necesaria. Así, que la cantidad de mionúcleos permaneciera intacta supondría una ventaja biológica a la hora de restablecer el rendimiento muscular después de un periodo en el que este se perdió.
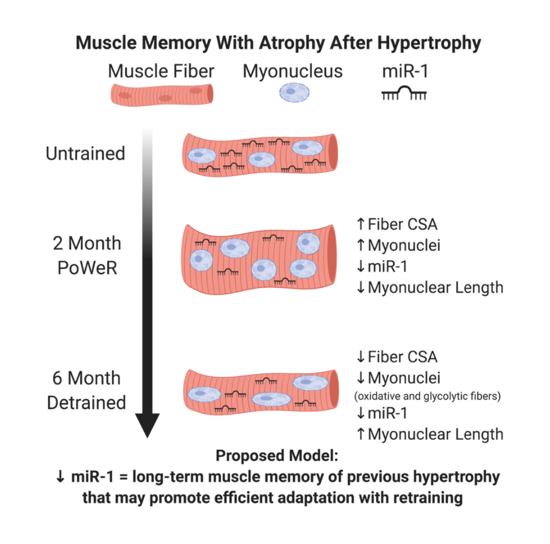
Todo esto ha llevado a varios expertos a la hipótesis de que la memoria muscular se debe a la permanencia de mionúcleos (Gundersen K., 2016). Según este modelo, cuando aplicamos estímulos a un músculo desentrenado, el producto es una fibra con mayor tamaño y mayor número de núcleos. Si se deja de entrenar, la masa muscular que se ganó, se pierde, cosa que no ocurre con los núcleos que se sumaron. De esta manera, cuando se retoma el entrenamiento, el aumento de masa muscular se acontece de una manera más rápida (ej. nos saltamos el aumento de número de núcleos).
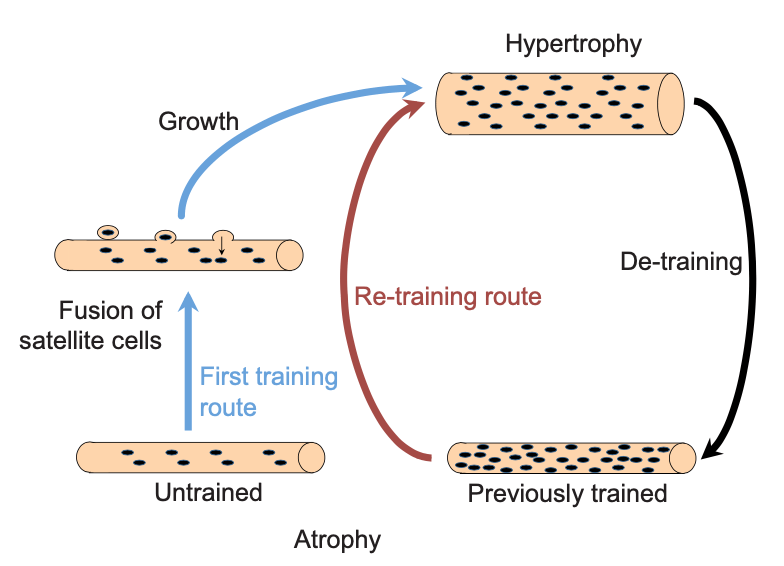
Problemas de la teoría de los mionúcleos
Snijders et al. publicaron una revisión en 2020 que nos muestra investigaciones con animales y humanos que nos hacen dudar de en cierta manera la teoría de los mionúcleos. A continuación se exponen los puntos más importantes.
Es cierto que en algunos estudios con humanos no se encontraron cambios en el contenido de mionúcleos cuando se reducía la masa muscular por una inmovilización, un reposo en cama o una reducción de la actividad física. Pero también lo es que otros han mostrado que durante un período de reducción total o parcial actividad física, así como tras un tiempo de exposición a microgravedad, puede aparecer una atrofia de las fibras musculares acompañada de una pérdida de mionúcleos.
Existe una teoría denominada “dominio mionuclear” que postula que existe una relación lineal entre el tamaño muscular y el contenido de mionucleos. Algo que se ha observado en varias ocasiones en humanos, aunque no en animales. En la siguiente figura se muestra la relación positiva existente entre el contenido de mionúcleos (excluyendo las células satélites) en las fibras tipo I (A) y tipo II (B) y el tamaño de las mismas. En las gráficas C y D se puede observar una asociación similar entre el tamaño de las fibras musculares y el tamaño del dominio de los mionúcleos (volumen de fibra muscular controlado por cada mionúcleo). Estos datos fueron obtenidos tras la evaluación de en torno a 400 personas que se movían en un rango de edad de entre 18 y 89 años.
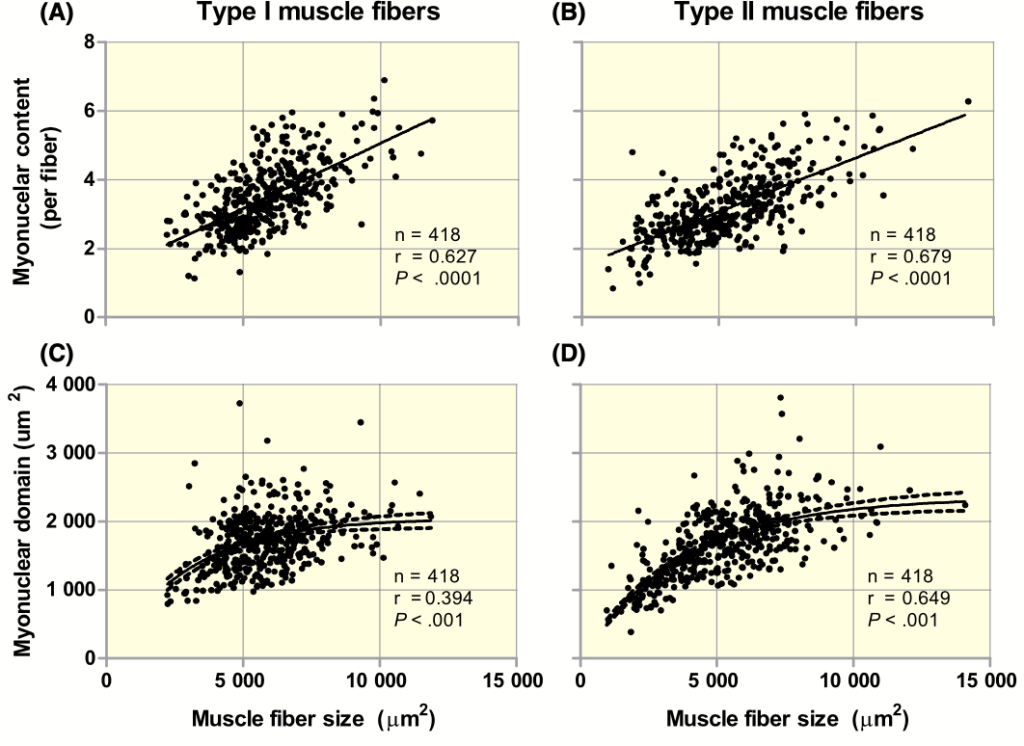
A resaltar que tras el análisis en profundidad de los datos se encontró que la relación entre el tamaño de fibra y contenido de mionúcleo se mantiene con el incremento de edad. El hecho de que el envejecimiento viene acompañado de un descenso del tamaño de las fibras musculares, sobre todo de las rápidas, esto sugiere que el contenido de mionúcleos es flexible y que es poco probable que se preserve de manera indefinida a lo largo de nuestra vida. En contraposición a esto, un estudio realizado por Kramer y colaboradores mostró que si bien esta relación se daba en mujeres jóvenes y mayores sanas, esta no se daba en aquellas mujeres mayores que habían sufrido una fractura de la cadera. Estas presentaban una menor área de sección transversal en comparación con las que no habían tenido esta fractura; sin embargo, no se encontraron diferencias entre estos grupos en el contenido de mionúcleos. Aunque se trata de un estudio transversal, estos hallazgos muestran que el contenido de mionúcleos se mantiene hasta cierto punto a pesar de que acontezca una atrofia muscular.
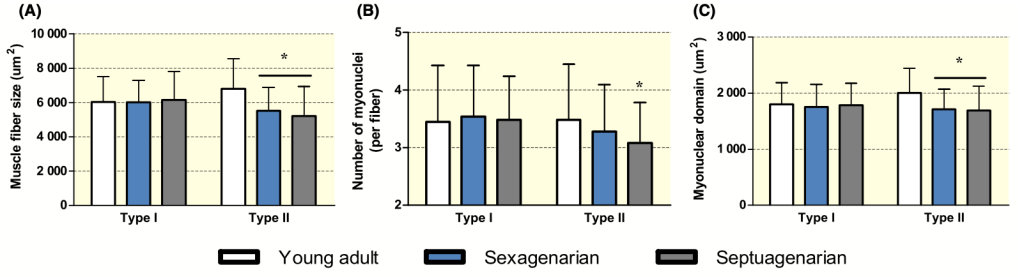
En la siguiente figura se muestra el tamaño de las fibras musculares tipo I y II, el contenido de mionúcleos y el tamaño del dominio de los mionúcleos en un grupo de más de 300 personas de diferentes edades. Se puede ver que las fibras tipo II en los mayores tienen un menor tamaño, menos mionúcleos y que estos tienen menos tamaño de dominio. Estos resultados van en la misma línea que los obtenidos en otras investigaciones y muestran que el contenido de mionúcleos no permanece estable a lo largo de la vida. Aunque es verdad que es un estudio transversal y que otros estudios no encontraron estas diferencias entre jóvenes y mayores.
Otro ejemplo que apoya esta idea podemos verlo en un estudio que mostró que después de estar 1 año sin entrenar, las personas presentaron una reducción significativa del tamaño de las fibras y del contenido de mionúcleos. O en una investigación que demostró que personas con una lesión de médula espinal presentan 9 años después del incidente un menor tamaño de fibras tipo I y II, así un menor contenido de mionúcleos, en comparación con personas sanas de la misma edad. O en otra que mostró algo similar cuando se realizó una comparativa entre personas con o sin esclerosis múltiple de la misma edad. Todos apoyan la misma idea: tras un período de desentrenamiento acontece una reducción en el contenido de mionúcleos. A nivel biológico tiene sentido; gestión eficiente de los recursos. Si no voy a usar algo ¿para qué lo quiero? Es algo similar a lo que ocurre con otras estructuras como las mitocondrias y los capilares. Cuando entreno su número aumenta, cuando dejo de hacerlo estas se pierden. Pero aunque es plausible, se necesitan más estudios que aclare todas las dudas que pueden surgir de esta teoría…
“En general, los estudios realizados con humanos no apoya la idea de que la cantidad de mionúcleos se mantega para siempre. No obstante, esto no niega la posibilidad de que el tamaño de dominio de los mionúcleos sea flexible y/o que un tamaño de domino relativamente pequeño pueda aumentar la capacidad de (re)crecimiento de las fibras musculares”
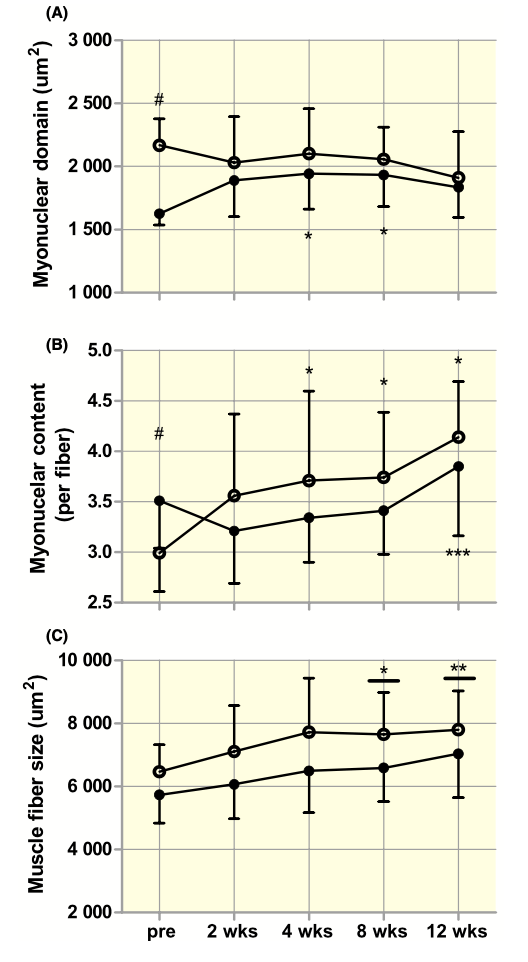
En la siguientes gráficas se puede comprobar los cambios producidos tras 2,4,8 y 12 semanas de entrenamiento de fuerza a nivel de hipertrofia, de contenido de mionúcleos y del tamaño del dominio de estos. Puede apreciarse la presencia de 2 grupos. Uno de ellos estaba formado por personas con un tamaño relativamente pequeño de dominio mionuclear (<1700 μm2) y otro por personas que presentaban uno mayor (>2000 μm2). Las ganancias de masa muscular fueron las mismas en ambos grupos; sin embargo, en el grupo que presentaba un mayor dominio a nivel basal el contenido de mionúcleos incrementó antes y en mayor medida. Al finalizar el programa de entrenamiento, ambos grupos presentaban el mismo tamaño de dominio de los mionúcleos. Esto concuerda con el concepto de que el tamaño del dominio mionuclear debe expandirse hasta cierto límite antes de que se añadan mionúcleos adicionales.
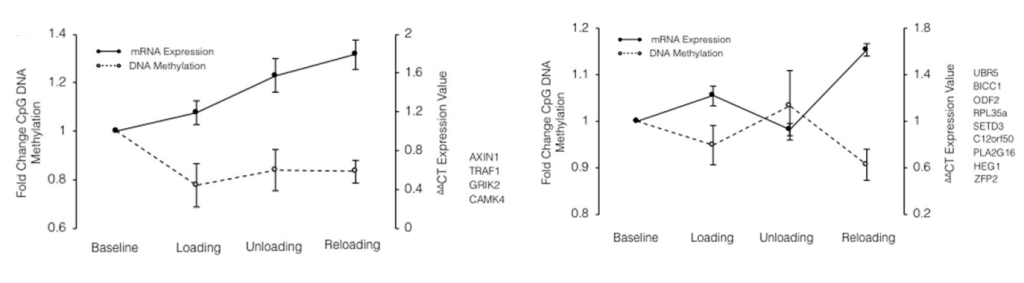
Teoría de la epigenética
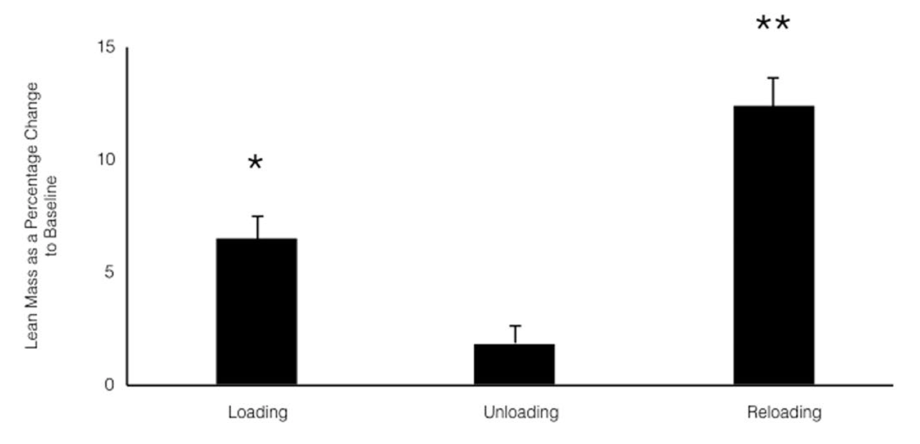
En la siguiente gráfica podemos ver un ejemplo de “memoria muscular”. Fase 1) entrenamiento de 7 semanas en las que hay un aumento de masa muscular del 6.5%. Fase 2) periodo de descarga de 7 semanas en las que los valores de masa muscular vuelven a niveles basales. Fase 3) entrenamiento de 7 semanas en las que el aumento de masa muscular es de un 12,4%.Algo similar ocurrió con la fuerza.