EFECTOS DEL FRÍO EN EL PROCESO DE REGENERACIÓN MUSCULAR
Hace ya unos años se publicó una investigación (Tagaki et al., 2011) en la que se estudió cómo era el proceso de regeneración después de una lesión muscular en función de si se modificaba o no la temperatura de la zona. De esta manera, dejaron que algunos animales se recuperaran sin intervención alguna, mientras que a otros les aplicaron frío durante 20 minutos con packs de hielo (0.3-1.3ºC) inmediatamente después de provocarles la lesión; llegando a conseguir una reducción de temperatura intramuscular hasta los 13ºC.
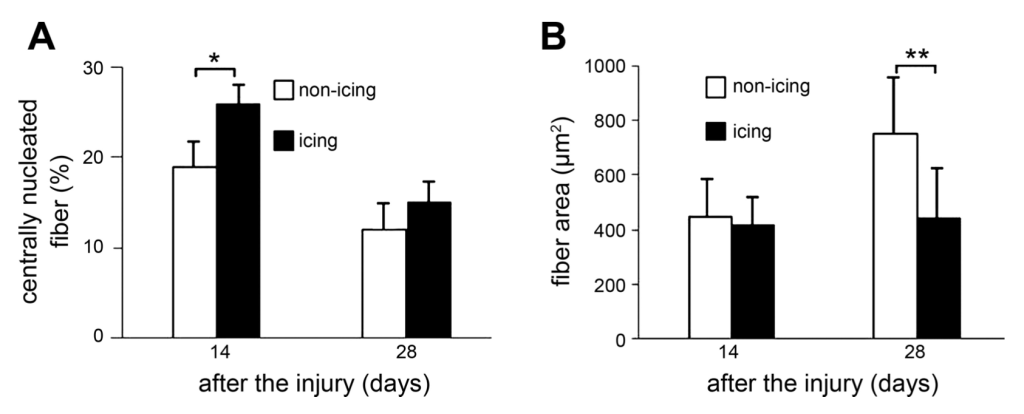
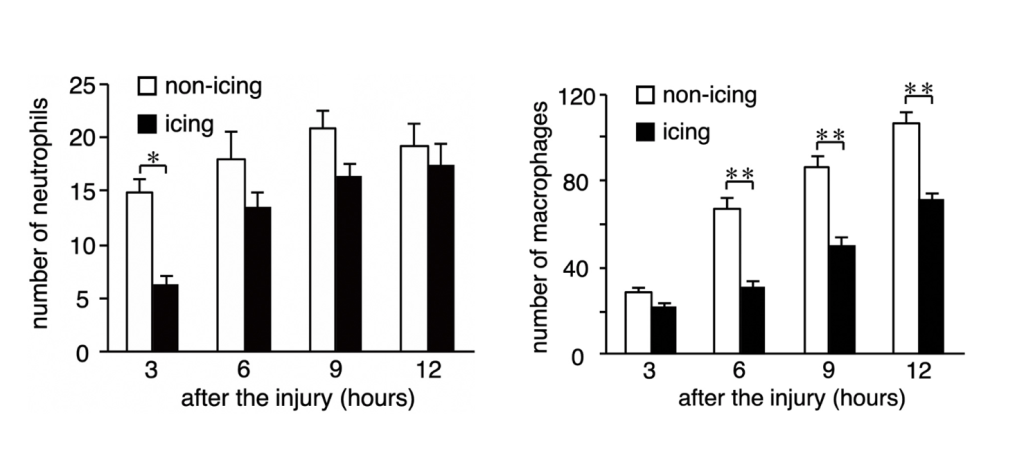
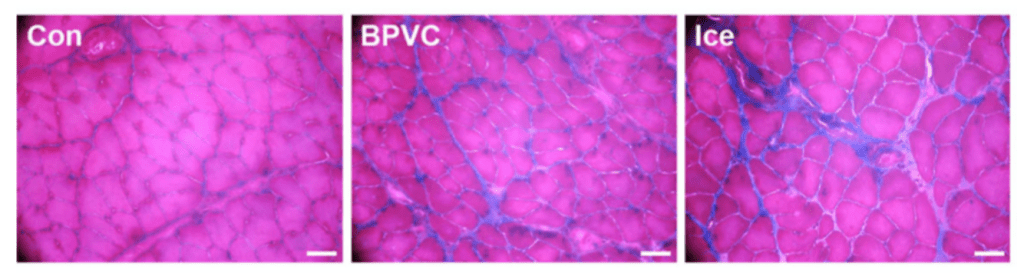
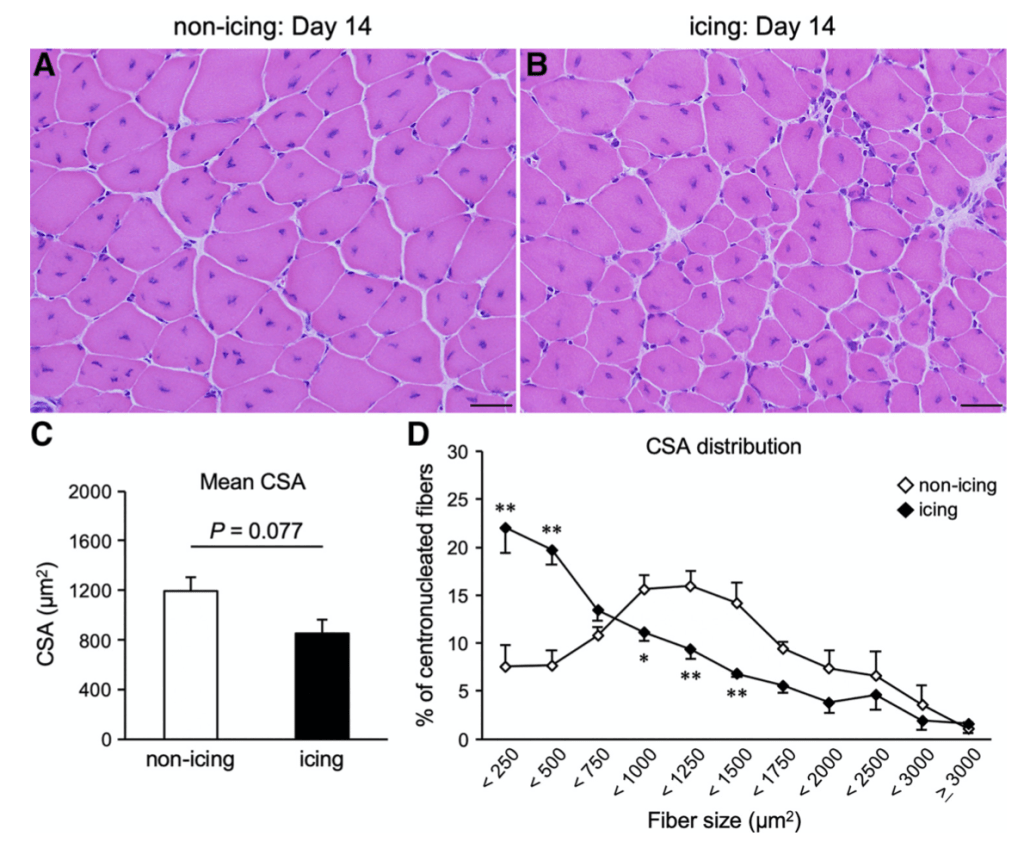
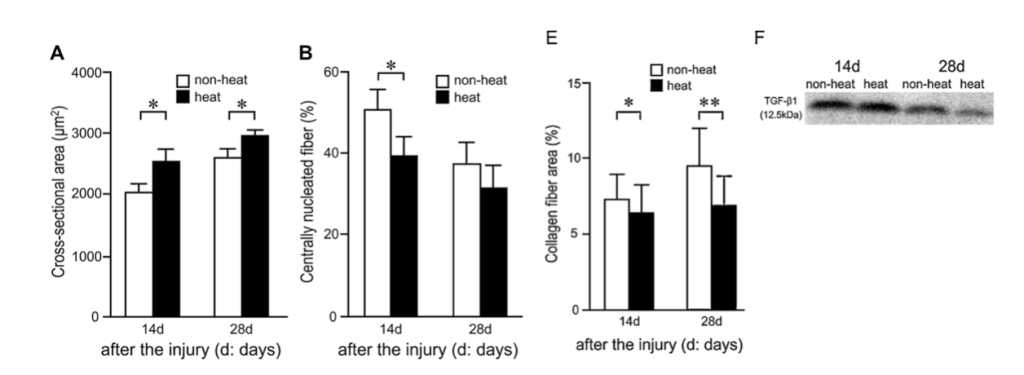
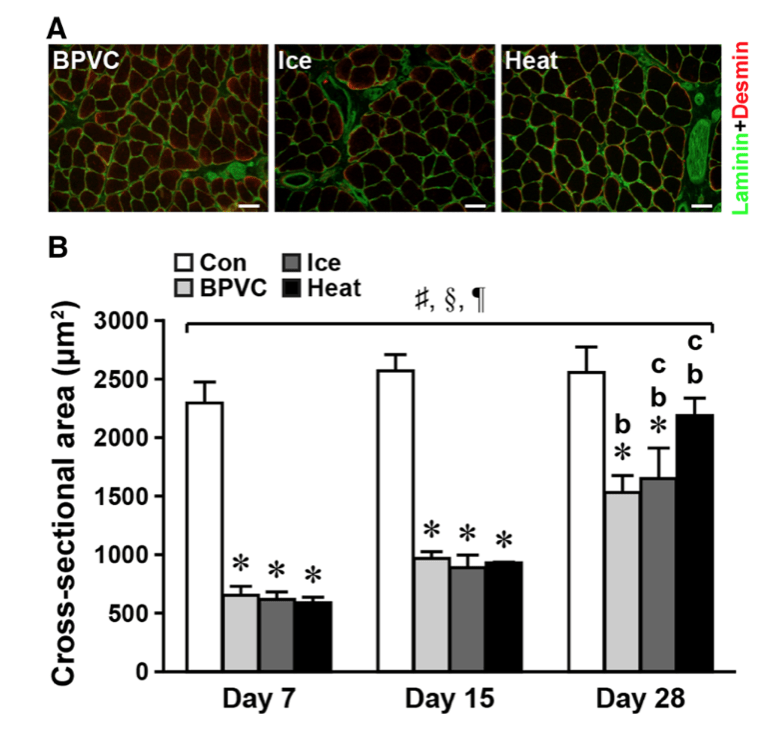
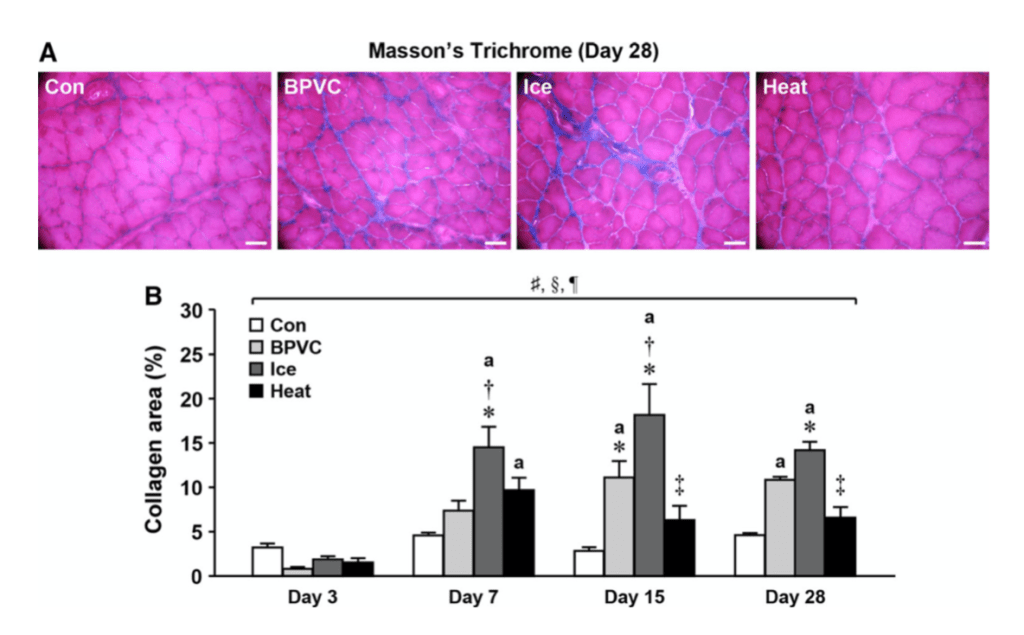
La degeneración de las fibras musculares y la aparición de macrófagos en la zona afectada se retrasó aproximadamente 24 horas en el grupo que recibió crioterapia. En consecuencia, también se demoró la expresión de los factores de crecimiento IGF-1 y TGF-β1 —el primero clave en la transformación fenotípica de macrófagos, en la proliferación de células satélites y en el crecimiento de células musculares. El segundo una de las citocinas fibróticas más potentes— . Asimismo, se retrasó la proliferación y diferenciación de las células satélite —que son coprotagonistas junto al sistema inmune en la regeneración muscular— . Como resultado de estos sucesos, en este grupo se observó un retraso de la migración del núcleo celular del centro a la periferia de las fibras musculares, un proceso que determina la maduración de las mismas. Además, 28 días después de acontecer la lesión, el área de sección transversal de las fibras regeneradas era sustancialmente inferior en aquellos animales que habían sido tratados con hielo (figura 1). Y no solo esto, la deposición de colágeno a los 14 y 28 días después de la lesión también fue significativamente superior en comparación con el grupo control.
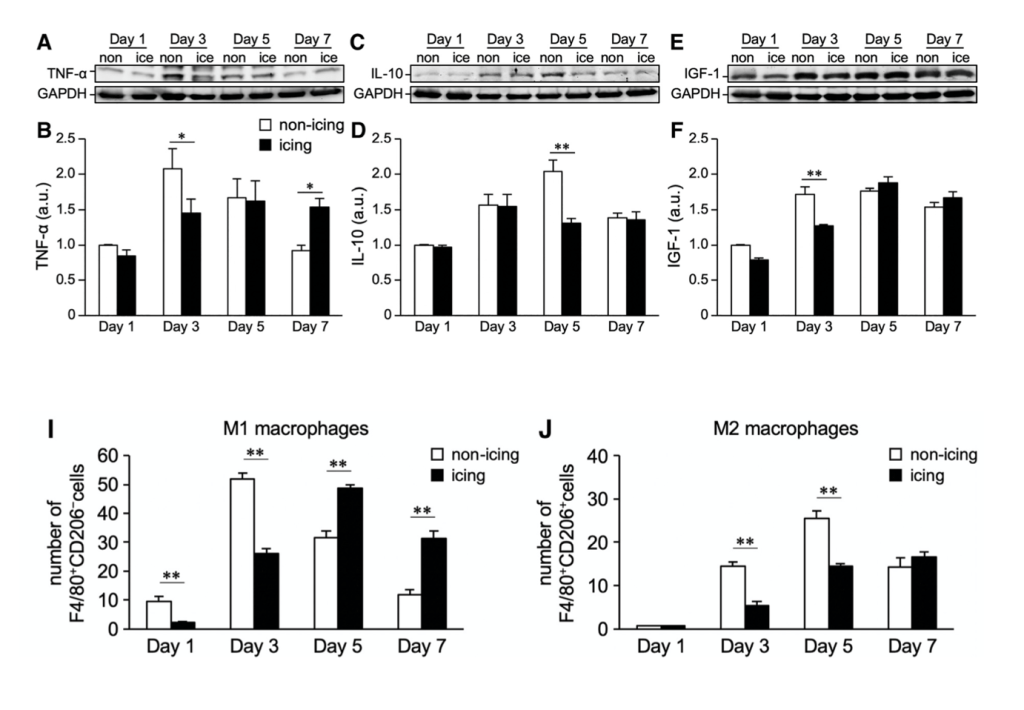
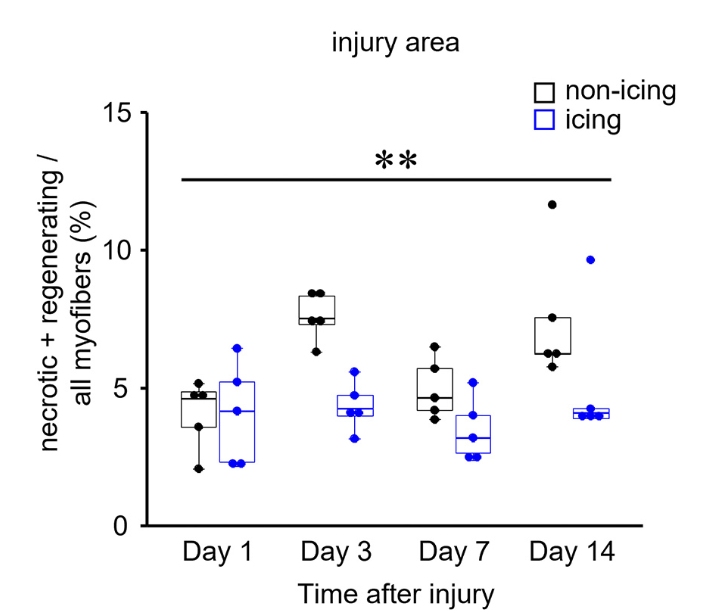
Incluso hay un estudio (Nagata et al., 2023) que ha mostrado recientemente que la aplicación de frío podría ayudar después de una lesión en la que hay poco tejido necrótico (de poca gravedad). En los casos anteriores la lesión provocó la muerte (necrosis) de más células musculares). En este caso se aplicó hielo en 3 series de 30 minutos justo después de la lesión, a las 24 y a las 48 horas. Esto no tuvo efectos significativos a nivel de neutrófilos ni en la expresión de MyoD y miogenina. No obstante, provocó una activación más temprana de las células satélite (día 3 frente a día 5), una menor acumulación de macrófagos M1 en los primeros días y una mayor fracción de macrófagos M2 el día 3 postlesión. Como resultado se vio que el área lesionada había aumentado desde el momento de la lesión al tercer día en el grupo control, pero no en cuando se les aplicó el paquete de hielo. A los 14 días se observó que el área lesionada era menor en el “grupo hielo” (figura 6). Las fibras musculares se regeneraron antes y el porcentaje de fibras regeneradas que tenían un gran tamaño también era mayor cuando los animales se recuperaron con la crioterapia.
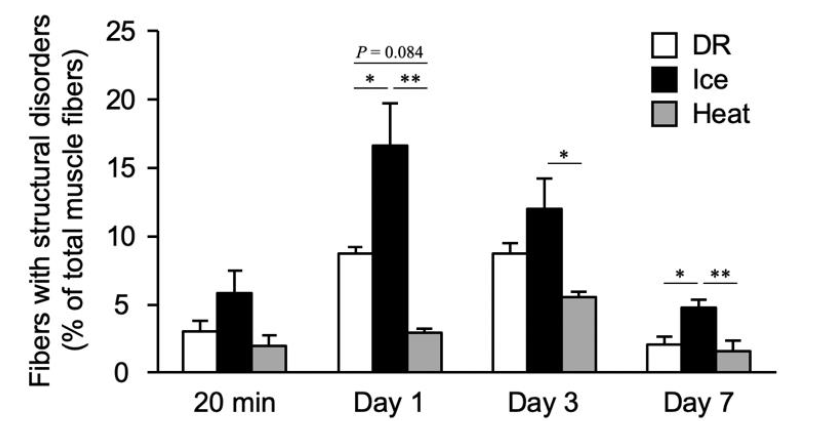
A la vista de estos últimos hallazgos, los autores del artículo concluían que la decisión de usar frío o no debe tomarse en función de la magnitud de daño muscular que se presente. Sin embargo, no parece que sea tan sencillo. Kawashima et al (2021) después de realizar una carrera cuesta abajo que produjo un daño en los tejidos, mostraron que al aplicar frío después del esfuerzo—paquete hielo durante 20min— la proporción de fibras que mostraban una alteración estructural era significativamente mayor (vs recuperación pasiva o con calor) al día siguiente, a los 3 y a los 7 días (figura 7).
Habrá que estar atentos a nuevos estudios que nos aclaren un poco más todo este tema…
EFECTOS DEL CALOR EN EL PROCESO DE REGENERACIÓN MUSCULAR
Veíamos que aplicar frío durante 20 minutos puede tener efectos negativos en la recuperación después de una lesión muscular. ¿Qué pasaría si aplicamos calor durante ese mismo período de tiempo?
En una investigación (Takeuchi et al., 2014) se aplicó calor, 5 minutos después de generarse la lesión y durante 20 minutos, utilizando una bolsa con agua caliente (42ºC). Con esta metodología se encontró que el músculo alcanzaba una temperatura de 38.5º aproximadamente y que esto, en comparación con un proceso de regeneración natural, potenciaba la migración de macrófagos a la zona dañada, la expresión de IGF-1, la presencia de células satélite.
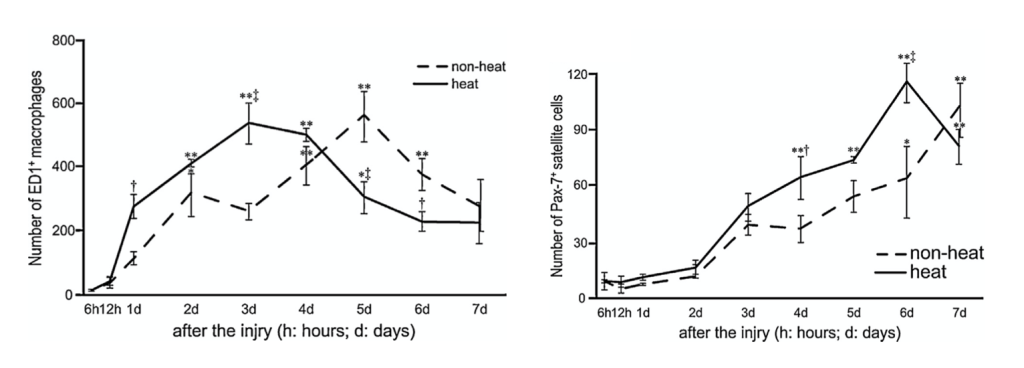
Esto provocó que los mionúcleos migraran antes hacia la periferia y las fibras alcanzaran un mayor área 28 días después de la lesión. En definitiva, que las fibras musculares maduraran antes. En este estudio también se demostró que con la termoterapia se conseguía un menor área en las fibras de colágeno, asociado este acontecimiento con una menor expresión de TGF-β a los 28 días de la lesión.
¿QUÉ PASA EN HUMANOS?
Ya vemos que la aplicación de calor parece aportar ciertos beneficios en la regeneración del tejido muscular. Sin embargo, para hacernos una mejor idea de lo que nos puede aportar el calor, a todos estos hallazgos de estudios realizados con animales o con fibras aisladas, habría que añadir los que se han obtenido en investigaciones realizadas con humanos. En estos estudios no se analizó la rapidez o la calidad de un proceso de regeneración muscular, pero sí que se muestran resultados que pueden hacernos posicionarnos a favor de la termoterapia.
Hemos visto que tanto la PGC-1a y las proteínas de choque térmico juegan un papel determinante sobre la estructura muscular (ej. control tamaño músculo y angiogénesis). A día de hoy contamos con estudios que han mostrado que la aplicación de calor es suficiente para lograr un aumento en su expresión (Kuhlenhoelter et al., 2016; Hafen et al., 2018; Hafen et al., 2019; Kim et al., 2020) (figura 14). Estudios que mostraron que con el uso exclusivo de termoterapia se puede lograr un aumento expresión de marcadores de crecimiento vascular, en los índices de vascularización, así como de la función y el contenido mitocondrial. Y que si se aplica calor durante un periodo de inmovilización no solo podemos lograr mantener la función de las mitocondrias, también reducir la atrofia muscular.
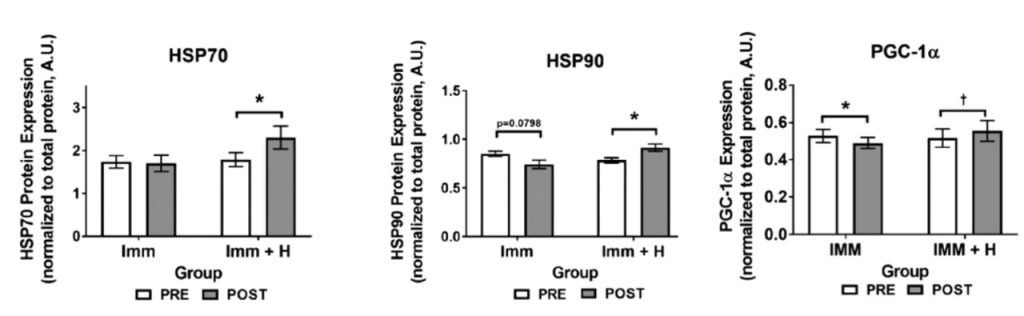
En línea con esto último, también hay evidencia de que con el calor podemos potenciar la cascada de señalización molecular (vía mTOR) que deriva en la síntesis de proteínas y aumentar la masa muscular y en rendimiento físico (Goto et al., 2011; Kakigi et al., 2011; Kim et al., 2020). Así como potenciar los efectos que tiene el ejercicio físico sobre estas variables (Nakamura et al. 2019). Aunque otras investigaciones no encontraron mejoras en la síntesis de proteína, en la propiedades contráctiles del músculo, en la fuerza o en la hipertrofia: Fuchs et al., 2020; Labidi et al., 2021). Atendiendo a los resultados y las metodologías de los estudios publicados, quizá con personas activas no tenga mucho sentido, pero sí que “puede tener utilidad como una contramedida para el desacondicionamiento y la degeneración muscular” (ver aquí).
¿Qué hay sobre crioterapia en humanos?
En base a los hallazgos obtenidos en estudios realizados con animales, podemos ver que cuando se alterna la dinámica natural de los procesos que se ponen en marcha en nuestro organismo para llevar a cabo una curación de un daño muscular (ej. sistema inmune), los resultados no son buenos. Al menos cuando la lesión afecta a bastante tejido muscular. En humanos, como he comentado, no hay evidencia de que la crioterapia empeore la regeneración del músculo, pero sí de que puede alterar esa dinámica fisiológica necesaria para que esta acontezca. Por ejemplo, se ha demostrado que los marcadores inflamatorios y la actividad de las células satélite pueden reducirse (ver aquí y aquí).
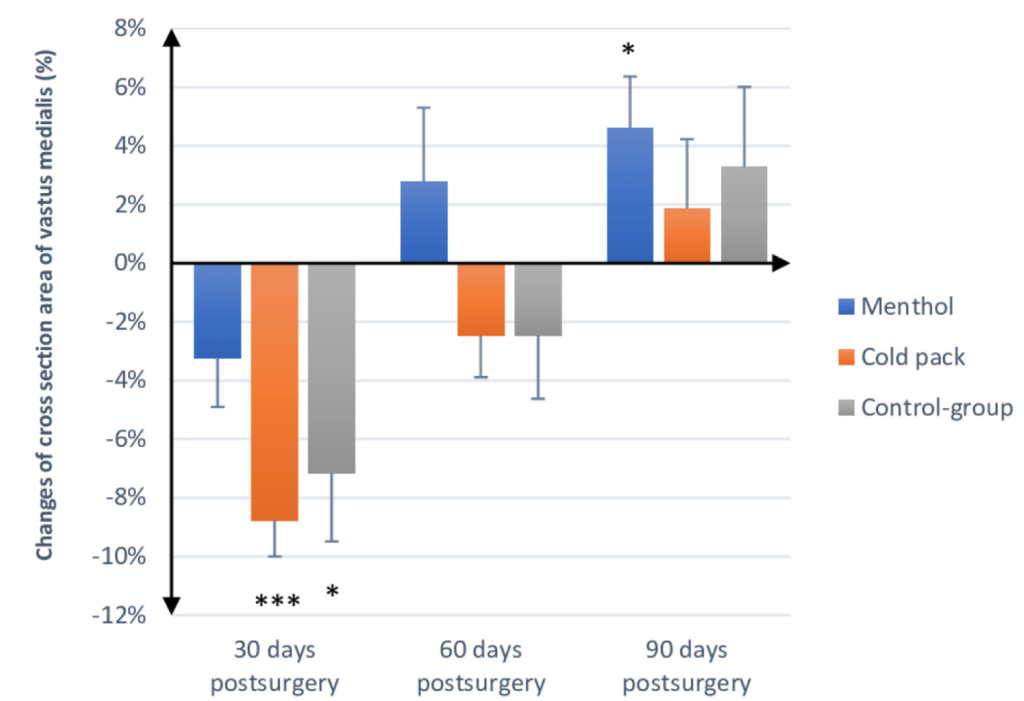
Si a esto le añadimos que la crioterapia parece reducir el contenido de proteínas de choque térmico y la señalización molecular necesaria para la síntesis de proteína miofibrilar y biogénesis ribosómica, que aumenta los niveles basales de marcadores de degradación de proteínas y que las ganancias de músculo y fuerza son menores cuando se aplica después de un entrenamiento (Yamane et al., 2006; Fröhlich et al., 2014; Yamane et al.,2015; Roberts et al., 2015; Figueiredo et al. 2016; Fyfe et al., 2019; Fuchs C et al., 2020), quizá deberíamos tener precaución con su uso… Puede hacernos sentir menos dolor, pero ¿a costa de qué? Podría ser interesante buscar alternativas, como el propio calor o cremas mentoladas que, sin reducir mucho la temperatura corporal, pueden reducir las molestias producidas por una lesión igual o más que el hielo, y favorece la recuperación de la masa muscular durante un programa de rehabilitación. Algo que Engelhard et al., (2019) mostraron que no parece pasar con humanos (figura 15).