Descarga este artículo en PDF
Existe una línea de pensamiento, extendida sobremanera, que aduce que con el ejercicio físico logramos mejorar el dolor de espalda por la modificación de la estructura (ej. área sección transversal) y la función (ej. control motor) de los músculos localizados en zonas cercanas a donde se experimenta el dolor.
Se postula que las personas con dolor en esta región presentan déficits en estas variables comentadas y que esto puede comprometer la integridad estructural de la espalda, favoreciendo la aparición de dolor. El ejercicio físico funciona al revertir esta situación. Eso sí, para ello debemos centrarnos en la mejora de la masa muscular, la fuerza o los patrones de activación de la musculatura estabilizadora del tronco.
Esta idea, aunque es no es necesariamente incorrecta, tiene varias limitaciones y es inexacta (ver aquí). El mensaje que subyace bajo ella es muy simplista y peca de mecanicista: cambiemos “una pieza defectuosa” para “arreglar la máquina”. Mensaje que choca de frente con la complejidad del comportamiento de los seres biológicos y del propio dolor, que nos puede llevar a planteamientos poco adecuados y que le quita méritos al movimiento como estrategia terapéutica.
El fin de las siguientes líneas es tratar de aclarar por qué al movernos —llámalo ejercicio físico o actividad física— podemos lograr una reducción sustancial del dolor. Me centro en los efectos a nivel del sistema inmunitario, del sistema de modulación descendente y sobre el eje afectivo-recompensa, pero no pensemos que acaban ahí. Cambios como la mejora en la cantidad y calidad muscular, así como el hecho de que alguien se sienta más fuerte, pueden ser objetivos a perseguir en cientos contextos. Tampoco quiero que se malinterprete el mensaje. No persigo quitarle valor a ningún tipo de ejercicio físico sino intentar ayudar a que se entienda la gran variedad de beneficios que alguien con dolor puede obtener al aumentar su nivel de actividad física.
Efectos del ejercicio físico sobre marcadores inflamatorios
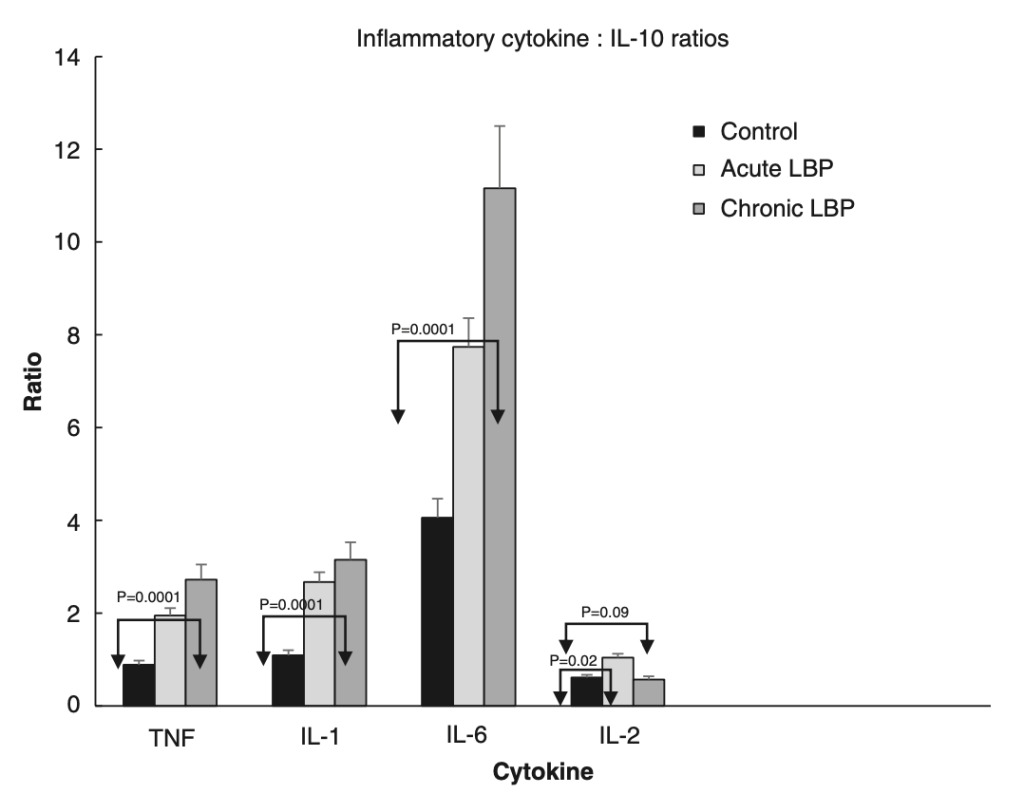
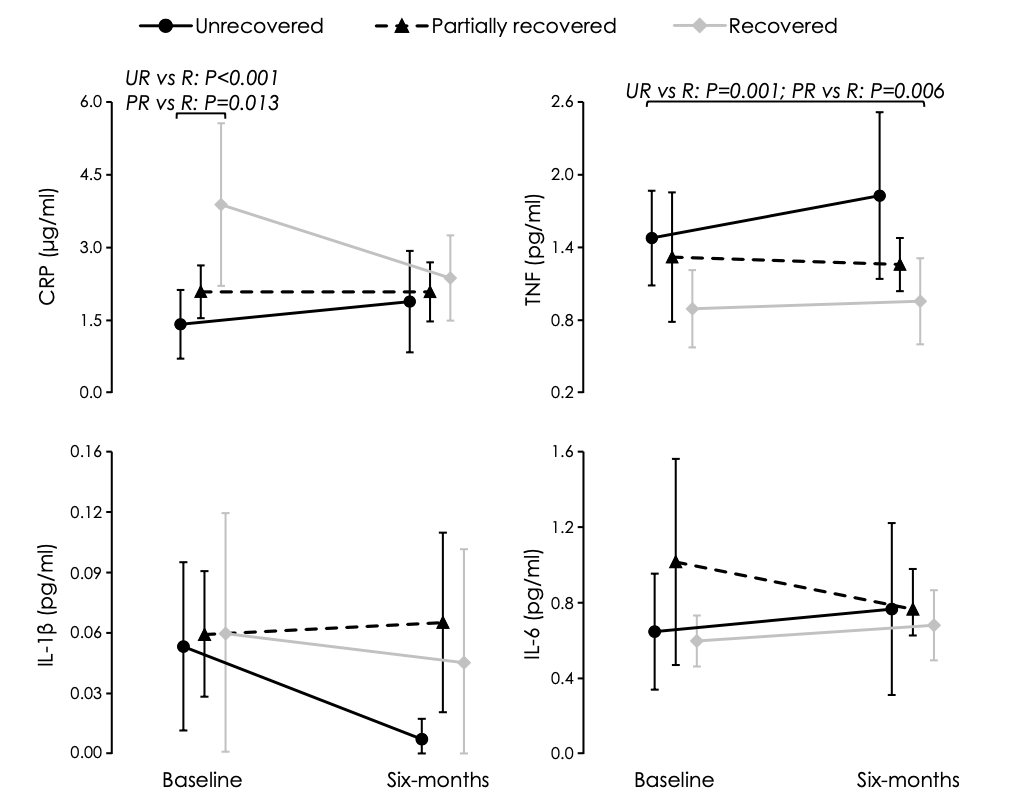
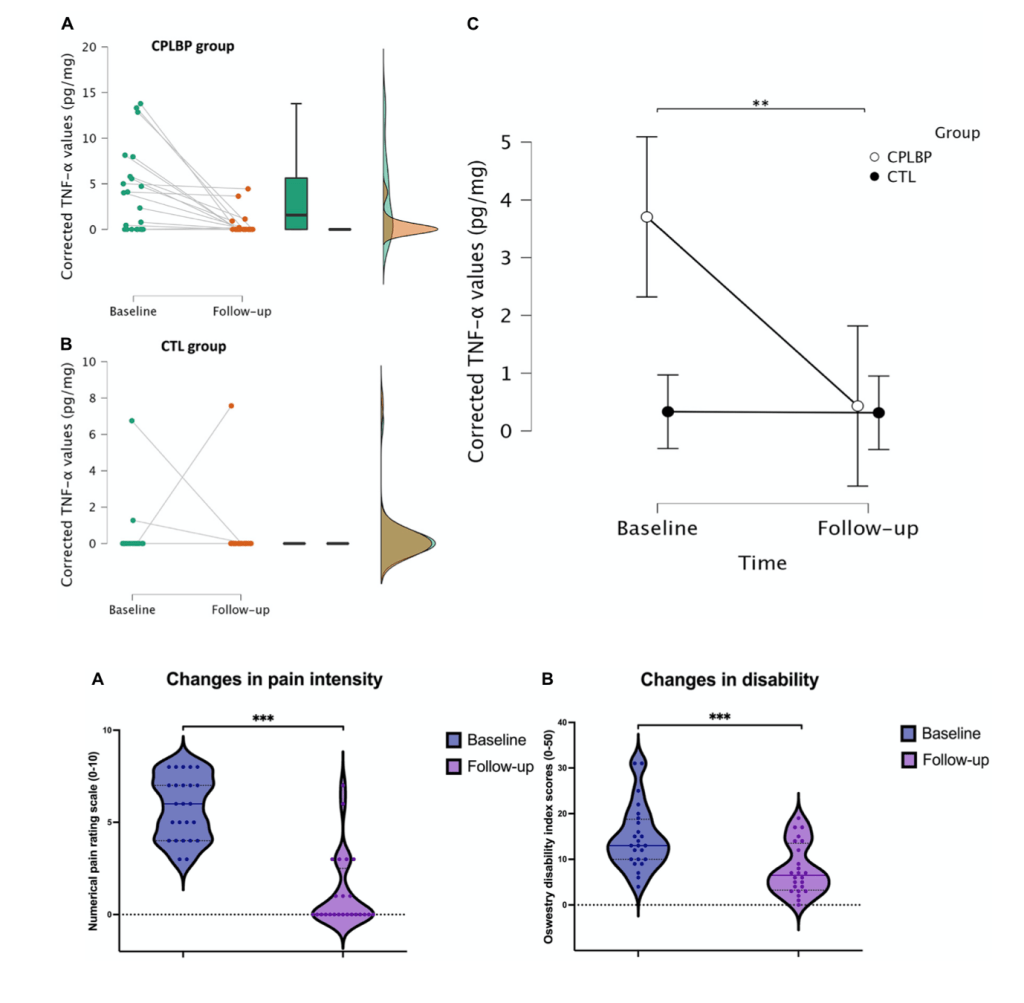
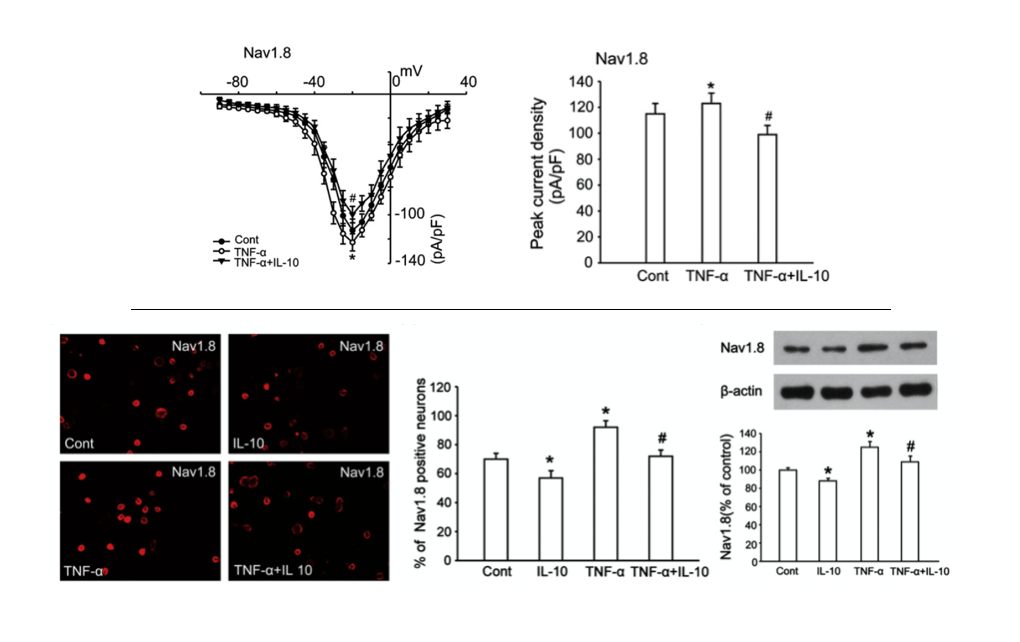
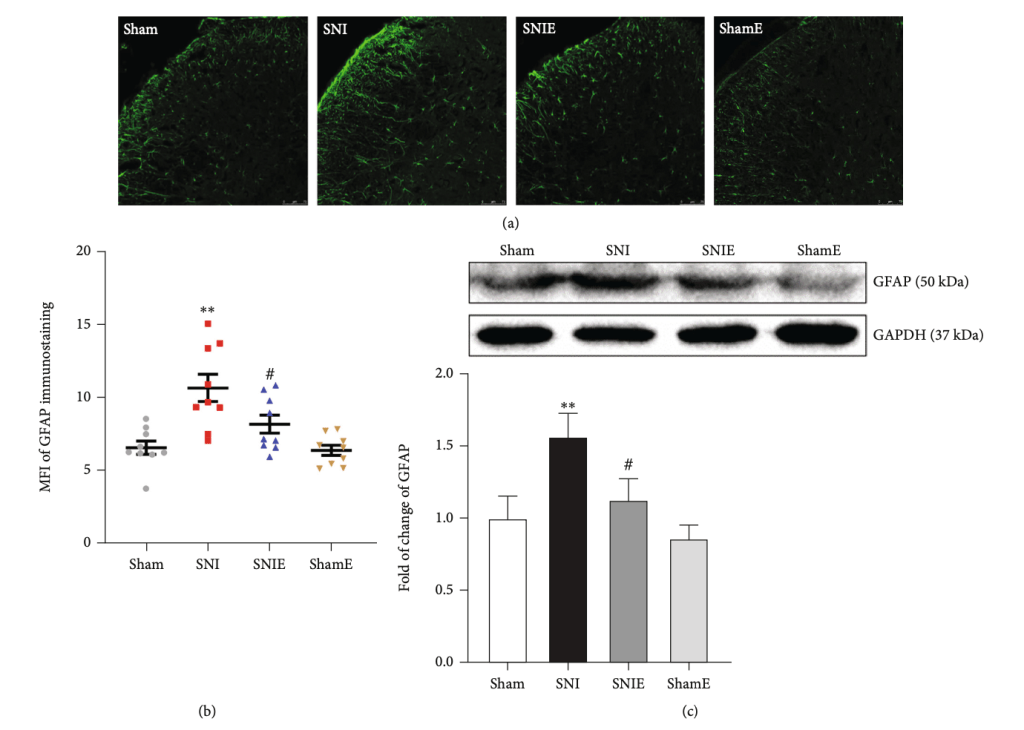
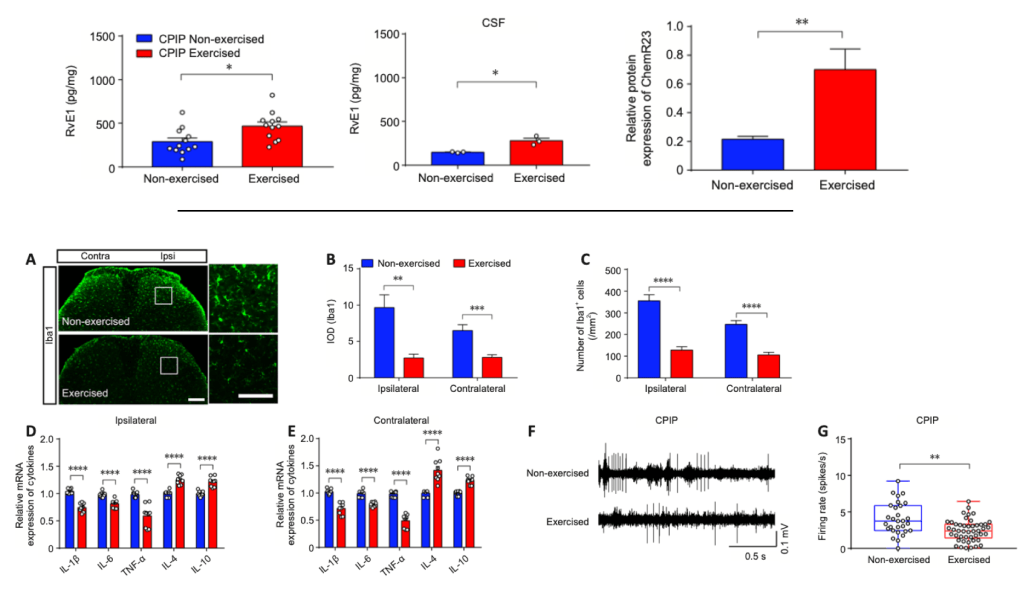
Diversas investigaciones han encontrado que las personas con dolor lumbar muestran, en términos generales y en comparación con personas asintomáticas, mayores niveles de varios marcadores de inflamación, en especial de CRP, IL-6 y TNFα (Lim et al., 2020). Y se ha visto que estas personas, ya tengan dolor agudo o persistente, no solo producen más citocinas inflamatorias, sino que también producen menos de las antiinflamatorias (ej. IL-10); lo que resulta en un desequilibrio en la presencia de estos 2 grandes conjuntos de citocinas y en un mayor ratio pro:antiiflamación (Teodorczyk-Injeyan et al., 2019; Pinto et al., 2023). En algunos casos, esta inflamación resultante se ha asociado de manera positiva con el dolor percibido en estas personas (van den Berg et al., 2018; Teodorczyk-Injeyan et al., 2019; Lim et al., 2020).

Efectos del ejercicio físico sobre el sistema de modulación descendente
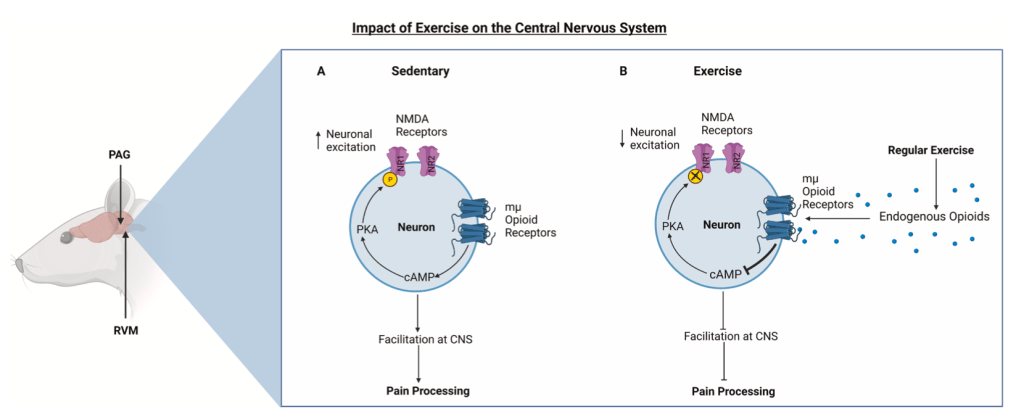
Uno de los mecanismos fisiológicos que nos impiden establecer una relación causal entre daño en los tejidos y dolor es la capacidad que tiene nuestro organismo para influir sobre la información nociceptiva. Con este fin contamos con un sistema de modulación descendente: red neural que regula el procesamiento nociceptivo en zonas como el asta dorsal de la médula espinal. De él forman parte diferentes regiones como corteza prefrontal (PFC) la sustancia gris periacueductal (PAG), la región reticular ventrobulbar (RVM), corteza cingulada anterior (ACC), amígdala e hipocampo (HPC), y sus conexiones permiten la facilitación o inhibición de las señales nociceptivas dependiendo del contexto en el que nos encontremos (ej. atención, expectativas…) (Tracey & Mantyh, 2007; Tracey & Dickenson, 2012; Bannister, 2019; Mills et al., 2021).
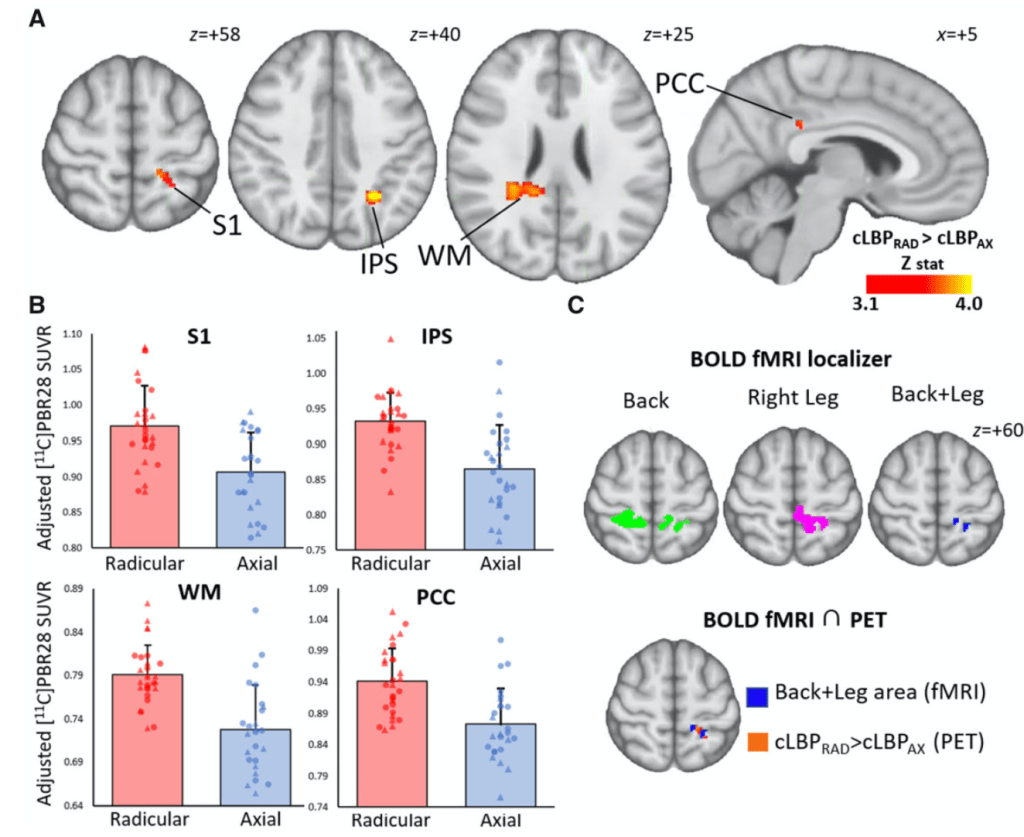
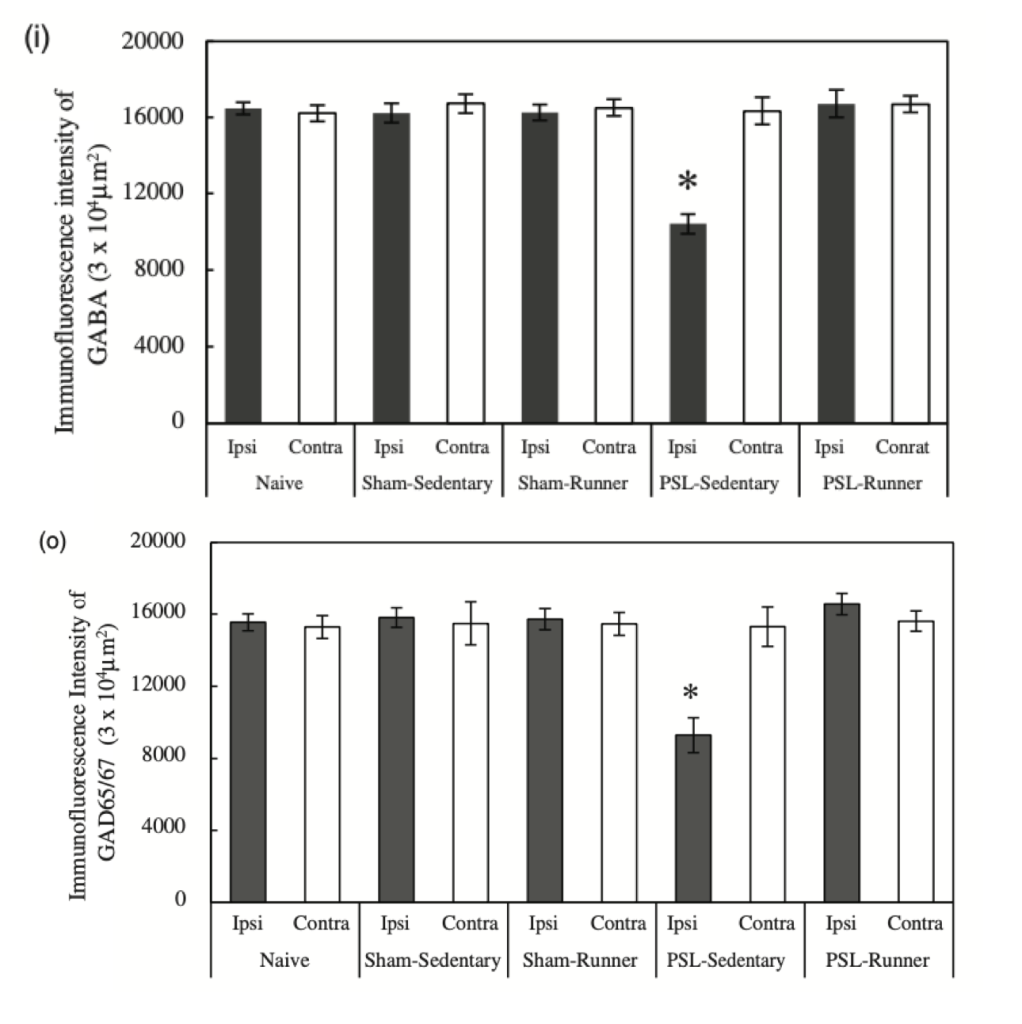
Se ha observado que las personas con dolor persistente en la zona baja de la espalda muestran características que animan a pensar que su sistema de modulación descendente no funciona como debería. Por ejemplo, presentan una disminución de flujo sanguíneo cerebral en PAG durante una estimulación mecánica (Giesecke et al., 2006), así como una falta de activación en la corteza prefrontal dorsolateral (DLPFC) y en la ACC ante un estímulo nocivo aplicado en la zona baja de la espalda, algo que se correlacionó de manera negativa con la severidad de los componentes sensoriales y afectivos del dolor (Matsuo et al., 2017).
Estos cambios estructurales y funcionales que presentan personas con dolor de espalda podrían estar detrás de una merma en la capacidad de inhibición o “antinociceptiva” de este sistema, a la vez que provocan una amplificación de las señales nociceptivas ascendentes (McPhee et al., 2020). Esto ha llevado al argumento que defiende que un balance desfavorable en señales inhibitorias y facilitadoras, en favor de estas últimas, podría facilitar la persistencia de dolor lumbar (Denk et al., 2014; Tracey, 2016). Por suerte somos sistemas biológicos con gran capacidad de adaptación y todo esto puede revertir (Seminowicz et al., 2011). Como veremos, el movimiento puede ser una estrategia interesante para lograrlo.
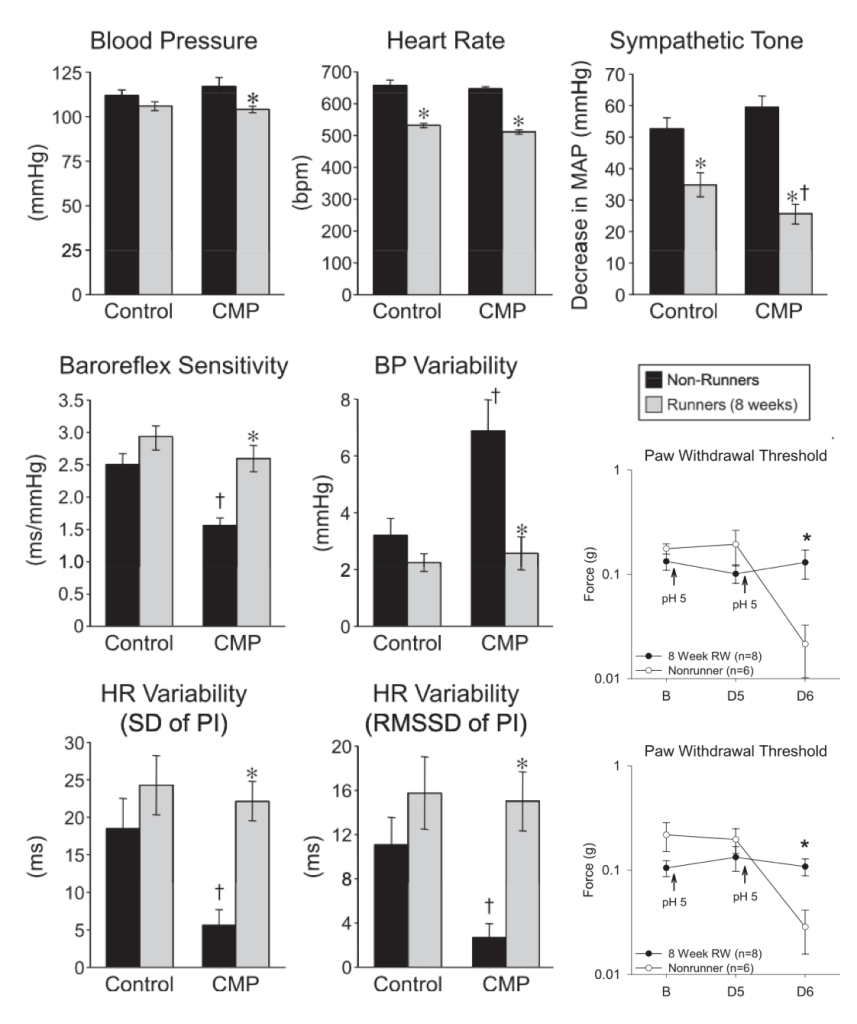
Sabharwal et al., (2016) observaron que tras la inducción de un estado de “dolor músculoesquelético crónico”, mediante la inyección de una solución salina y la producción de fatiga, se producía un estado de hiperalgesia acompañado de una alteración de diferentes variables del sistema nervioso autónomo, como la sensibilidad barorrefleja, presión sanguínea y la variabilidad de la frecuencia cardíaca. Tras un período de ejercicio aeróbico, comprobaron que estos efectos secundarios que producía el estado de sensibilidad inducido se eliminaban. Debido al solapamiento anatómico y funcional entre los sistemas que regulan el control cardiovascular y del dolor, estos autores sugieren que la actividad de ciertos circuitos neurales que afecta a la regulación autónoma también inhiben el dolor.
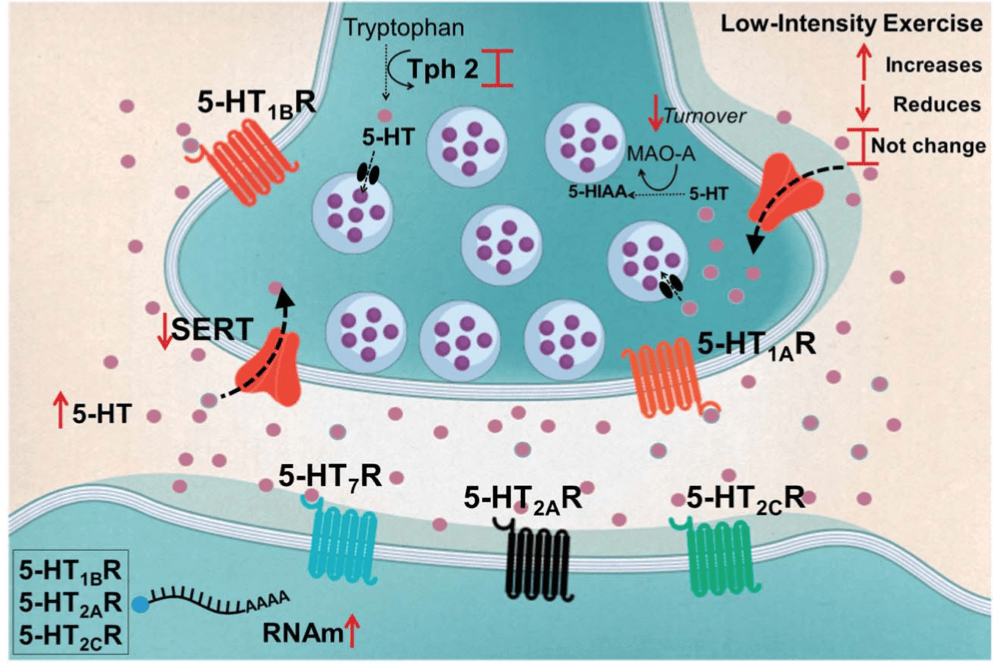
Efectos del ejercicio físico sobre el sistema mesocorticolímbico (emociones-recompensa)
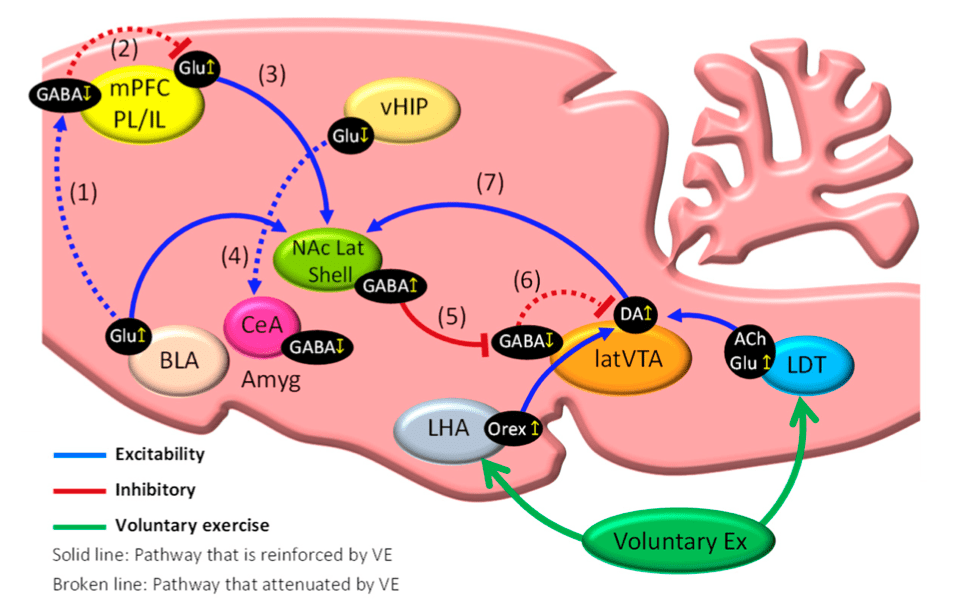
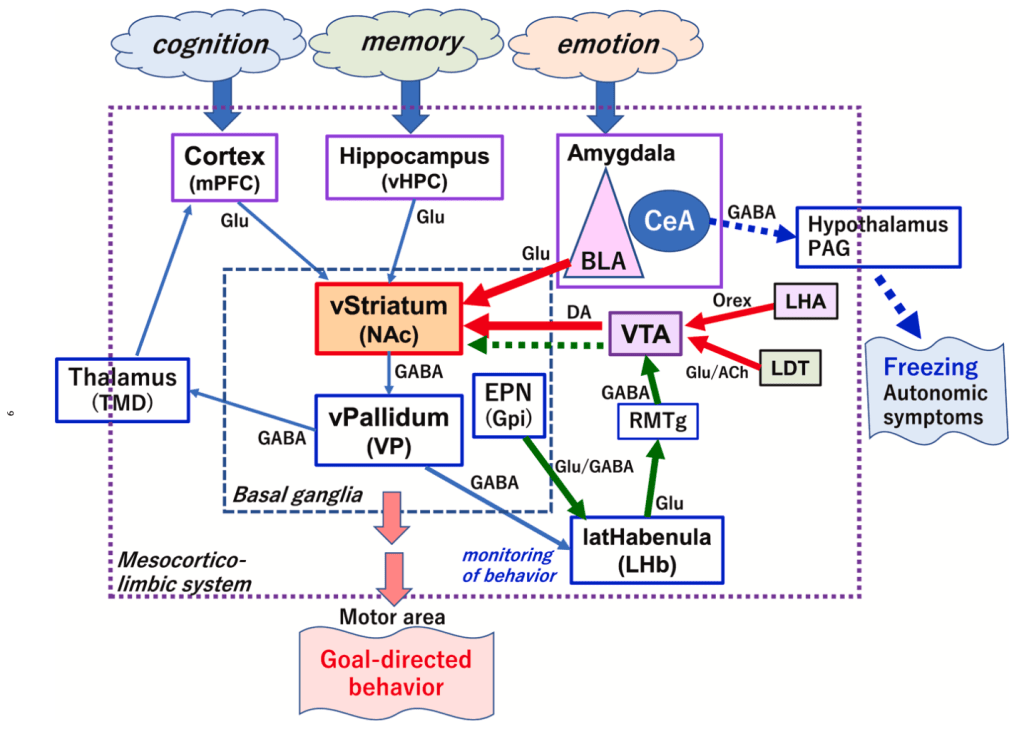
Se entiende como sistema mesocorticolímbico a la unión de 2 subsistemas en ocasiones estudiados de manera independiente: el sistema de recompensa (ej. proyecciones dopaminérgicas desde el área tegmental ventral (VTA) hacia el núcleo accummbens (NAc)) y el sistema emocional o límbico (ej. amígdala, corteza prefrontal medial (mPFC), hipocampo (HPC)).
Sabemos que las personas con dolor persistente de espalda presentan diversas alteraciones en este sistema mesocorticolímbico que se relaciona con su sintomatología. Por ejemplo, en un estudio longitudinal de tres años de duración observó que una mayor conexión funcional y estructural entre corteza prefrontal dorsomedial, amígdala y NAc durante fase de dolor agudo se correlaciona con la transición a dolor crónico (Vachon-Presseau et al., 2016). Hay quien argumenta que una mayor conectividad funcional entre estas áreas se puede traducir como “una incapacidad para mover sus cuerpos (inmovilidad) debido al miedo al dolor y por tanto son personas que caen fácilmente en un pensamiento de miedo-evitación mediante el cual el dolor aumenta y persiste” (Senba & Kami, 2023).
El NAc actúa como “interfaz que conecta los sistemas límbico y motor mediante el cual la “motivación” se traduce en “acción” (Senba & Kami, 2023). Así, nuestro comportamiento está supeditado a cómo funcionan todas estas áreas del sistema mesocorticolímbico y en particular a cómo lo hace el NAc. Importante tenerlo en mente cuando se sabe que personas con dolor persistente de espalda presentan un NAc de menor volumen de materia gris, un patrón de activación y de conectividad funcional diferente a personas asintomáticas (Baliki et al., 2010; Baliki et al., 2012) y una alteración de la respuesta dopaminérgica (menor liberación dopamina y activación receptores) en dicha zona en casos de dolor experimental (Martikainen et al., 2015).
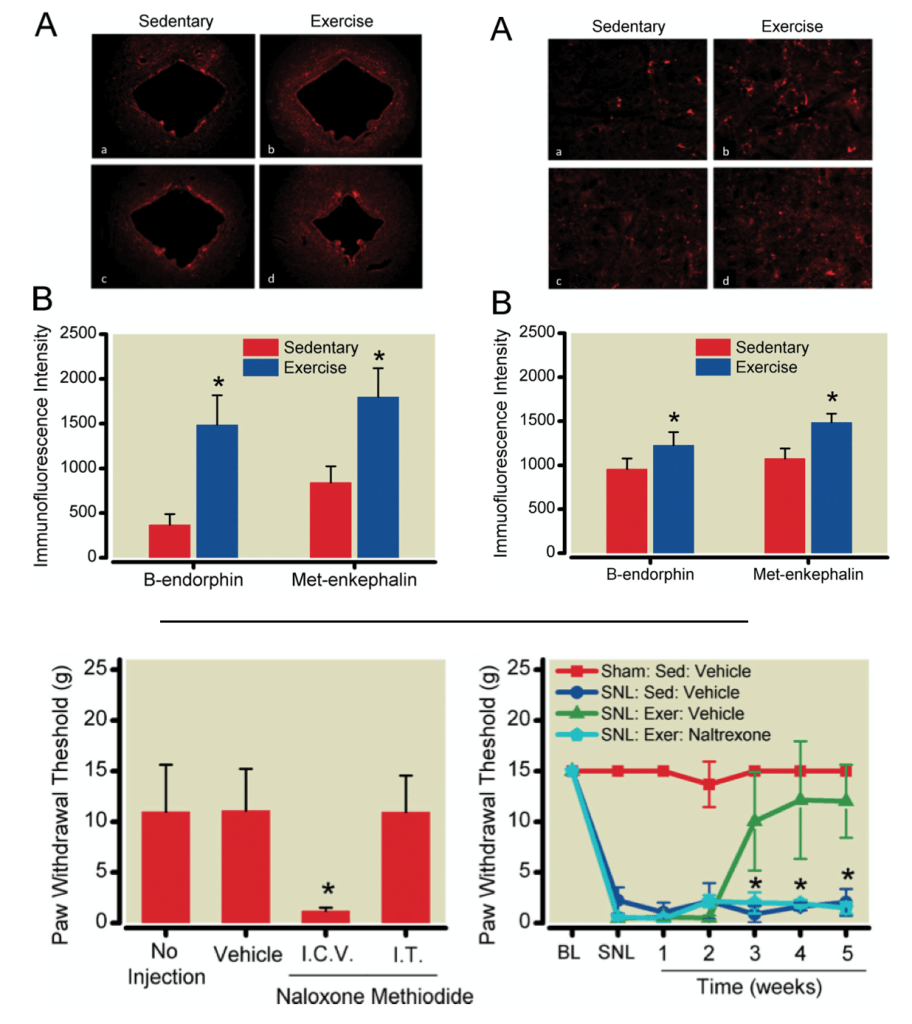
Contamos con investigaciones que demostraron que tras varios días realizando ejercicio puede apreciarse una recuperación progresiva del umbral de dolor asociada a una mayor activación de neuronas orexinérgicas en el área lateral del hipotálamo (LHA) y de neuronas glutamatérgicas y colinérgicas en el área tegmental dorsolateral (LDT), que a su vez activan neuronas de la región lateral del VTA (lVTA) (Kami et al., 2018) y favorecen una mayor síntesis de dopamina en esta región, desde donde se proyecta esta dopamina hacia la parte lateral del NAc. Esto es muy relevante en un contexto de dolor, ya que nos dice que se está activando el sistema de recompensa (sistema lateral: LDT-lVTA-lNAc), lo que genera una “mejora del dolor y de la calidad de vida”(Senba & Kami, 2023). Hecho demostrado en estudios donde la inyección de agonistas de receptores de dopamina en el NAc causó un estado de analgesia y en otros donde la supresión selectiva de neuronas dopaminérgicas en VTA impidió que aconteciera una mejora del dolor tras la realización de ejercicio físico (Senba & Kami, 2023).
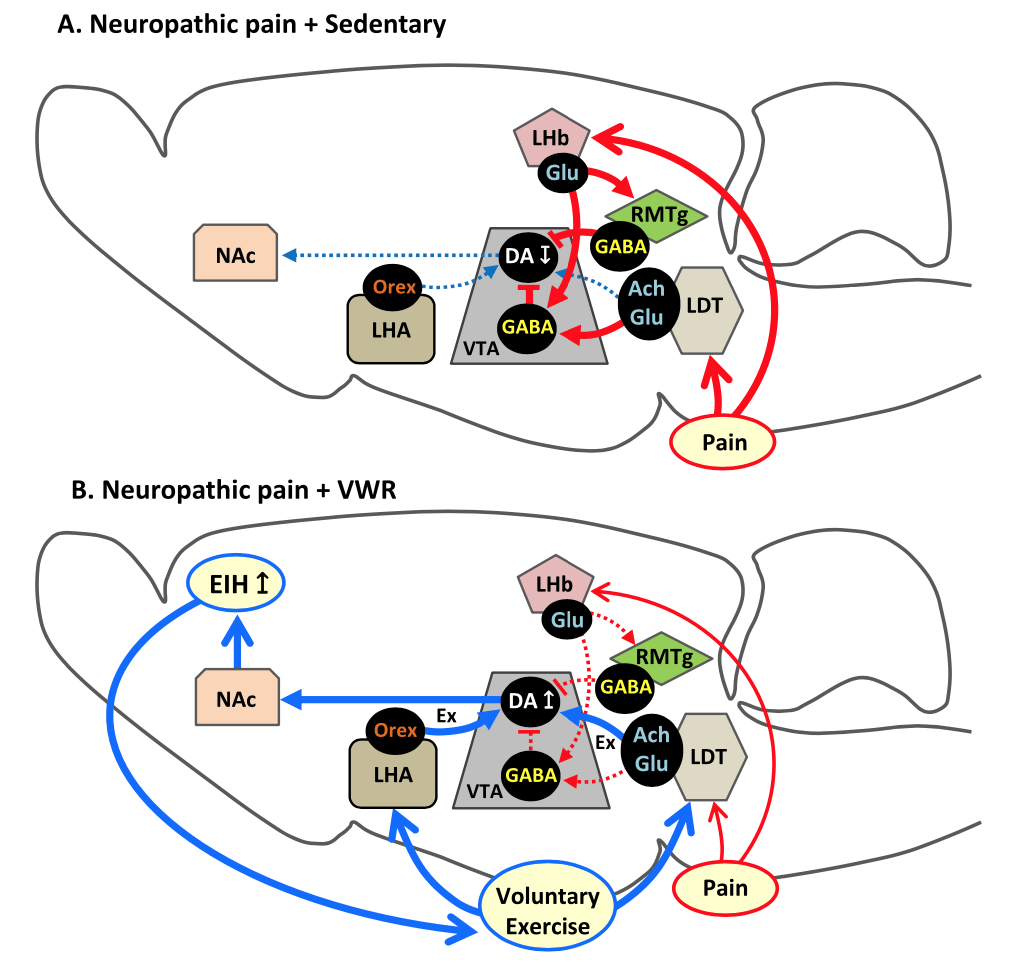
Cuando nos encontramos en una situación estresante, como puede ser el caso de un dolor, se ha observado un aumento en la actividad de neuronas en la zona ventral del hipocampo en la región 1 (vHPC-CA1) que se asocia a emociones negativas (ej. estrés y ansiedad) y con comportamientos de evitación. Otra de las vías por las que el ejercicio puede ayudarnos a reducir dolor y comportamientos asociados sería mediante la reducción de la actividad de estas neuronas (Minami et al., 2023). Asimismo, se ha observado un que con el ejercicio se puede lograr un incremento en la expresión de marcadores de neurogenesis (DCX y PROX1) en el giro dentado del hipocampo, cuya inhibición se asocia a alteraciones cognitivas y emocionales (Sumizono et al., 2022).
Las conexiones entre el hipocampo y la amígdala también tienen un rol fundamental en contextos de dolor. En particular, el área ventral del hipocampo (vHPC) proyecta hacia la amigadla basal y central para formar y reproducir memorias relacionadas con el miedo, respectivamente. Con el ejercicio físico se puede reducir estas proyecciones vHPC-amígdala, que están activas en situaciones de lesión y dolor, lo que podría prevenir el aprendizaje y expresión de miedos. A su vez, el aumento de la neurogénesis en el hipocampo o el incremento en la actividad de la mPFC (en particular la zona ventromedial, vmPFC) también ayudarían a diminuir la manifestación de miedos y favorecerían la extinción de los mismos (Senba & Kami, 2023). Si entendemos el dolor persistente como el resultado de aprendizaje adquirido (ej. por condicionamiento) y a una incapacidad para extinguir esa “memoria de dolor” vemos que estos efectos del ejercicio son de gran ayuda para que una persona recupere su vida sin dolor.