Descarga este artículo en PDF
La inflamación como aliada y el papel de los SPMs
No deberíamos demonizar la inflamación aguda que acontece tras un daño en un tejido. Es un proceso que puede doler y que altera los rasgos anatómicos de la zona afectada (ej. tu tobillo parece una papa nueva), pero se trata de un mecanismo fisiológico natural y necesario para que se produzca una regeneración adecuada (Tidball et al., 2017; Howard et al., 2020).
Después de cientos de miles de años de evolución, en nuestro organismo se ha desarrollado un “sistema de reparaciones” con varias fases y, nos guste o no, una de ellas se caracteriza por la liberación de sustancias inflamatorias. Y si es así, por algo será.
Los humanos, como ocurre muchas veces, nos creemos más listos que la evolución y en algún momento pensamos que eliminar el proceso inflamatorio podría ser una buena idea. Menos dolor y una recuperación más rápida. Una idea que, en base a lo que se puede encontrar en la literatura científica, quizá sea errónea.
Para un mejor entendimiento de lo que digo, veamos un ejemplo de una función que tienen las señalizaciones moleculares inflamatorias en un proceso de regeneración de un músculo dañado.
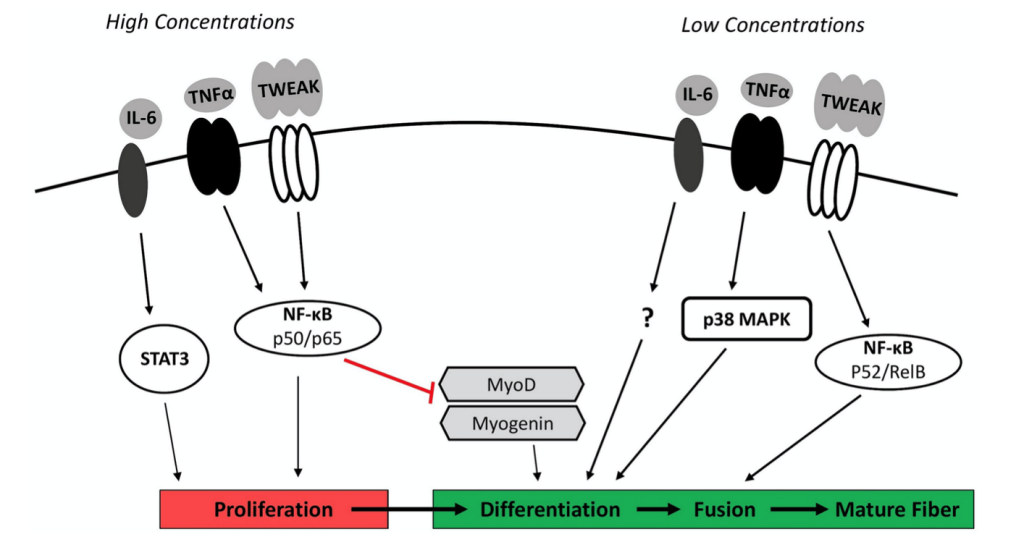
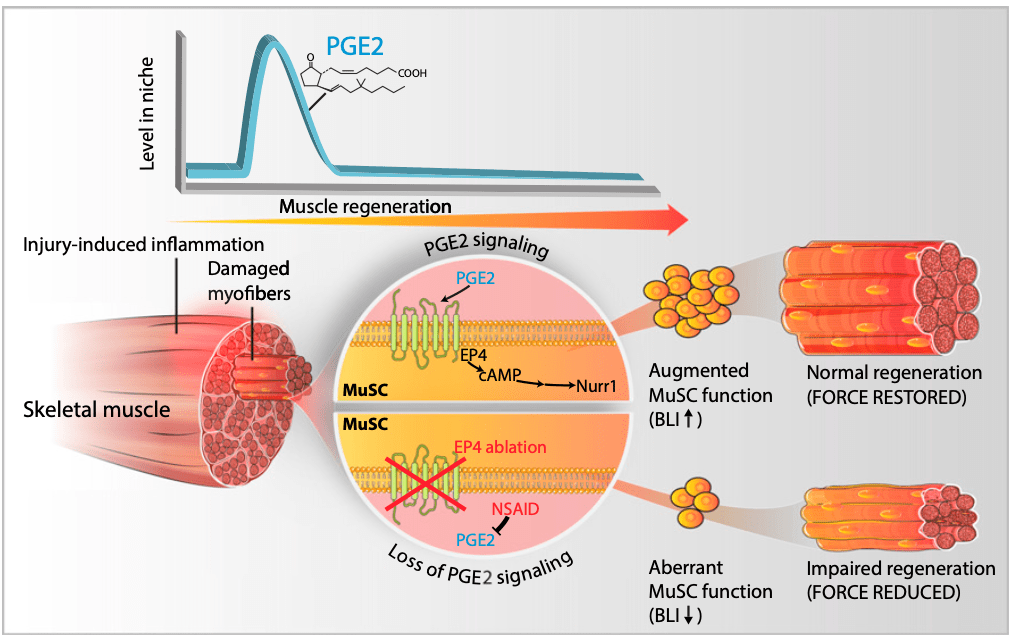
En un caso como este, las células satélite del músculo (células madre) llegarán al lugar lesionado para formar nuevas fibras musculares que reemplacen a las dañadas. Esta transformación requiere de varios pasos: activación, proliferación y diferenciación de estas células madre hacia fibras musculares maduras. Y a la vez que esto ocurre, el sistema inmune también irá actuando. Neutrófilos y macrófagos M1 serán los primeros en actuar y lo que hacen, además de fagocitar (eliminar células muertas), es liberar sustancias inflamatorias (ej. TNF-a, IFN-y…). Esto tiene diversas funciones, pero voy a centrarme en una en concreto: inhibir la miogenina. La miogenina es un factor de transcripción necesario para haya una transición desde la fase de proliferación hacia la diferenciación de las células satélite. ¿Qué ocurre si reducimos forma sustancial la expresión sustancias inflamatorias en esta primera parte de la recuperación de una lesión muscular? Que estas células dejan de proliferar antes de tiempo y como resultado podremos ver un tejido muscular que se ha recuperado peor (Tidball et al., 2017; Howard et al., 2020).
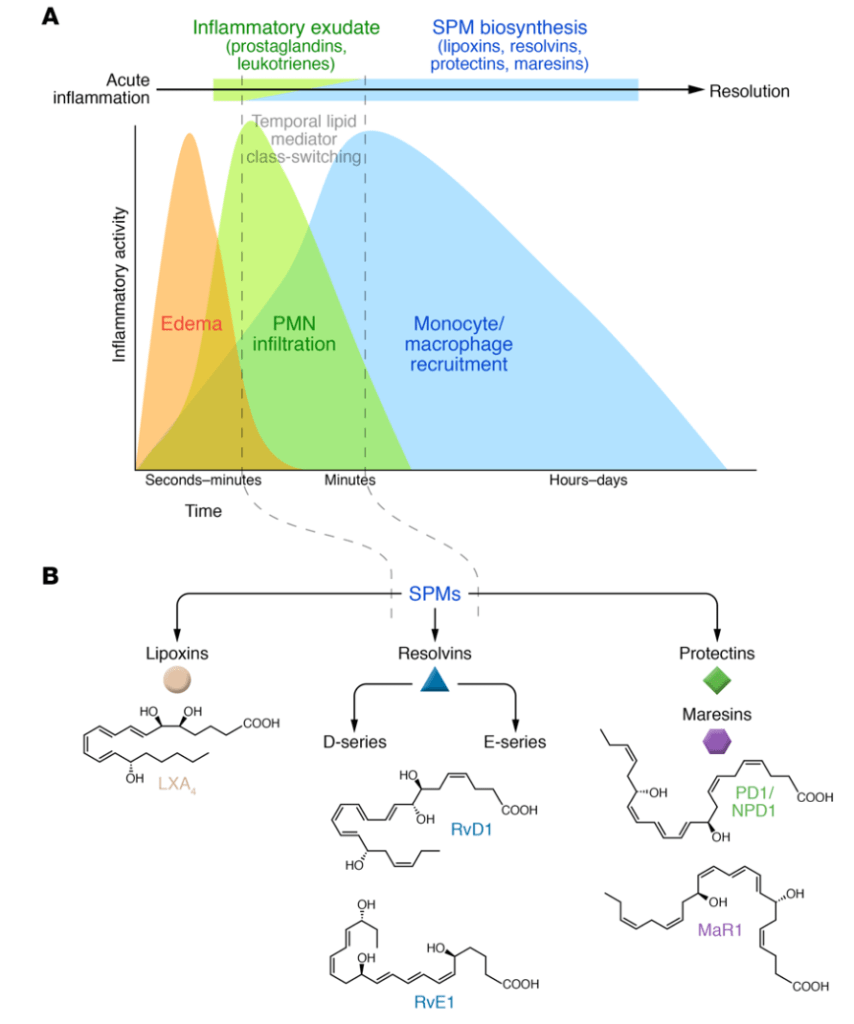
Omega 3, regeneración de los tejidos y sensibilidad al dolor
Estos mediadores lipídicos, los SPMs, se pueden inyectar como se ha hecho en diversos estudios con animales, y seguro en que en poco tiempo podremos comprarlos en farmacias, pero existe otra forma de aumentar sus niveles en sangre: la alimentación o suplementación. ¿Cómo? Fácil. Los SPMs derivan de los ácidos grasos poliinsaturados omega 6 (ácido araquidónico; AA) y omega 3 (ácido eicosapentaenoico: EPA, y ácido docosahexaenoico: DHA) (Serhan et al., 2015)

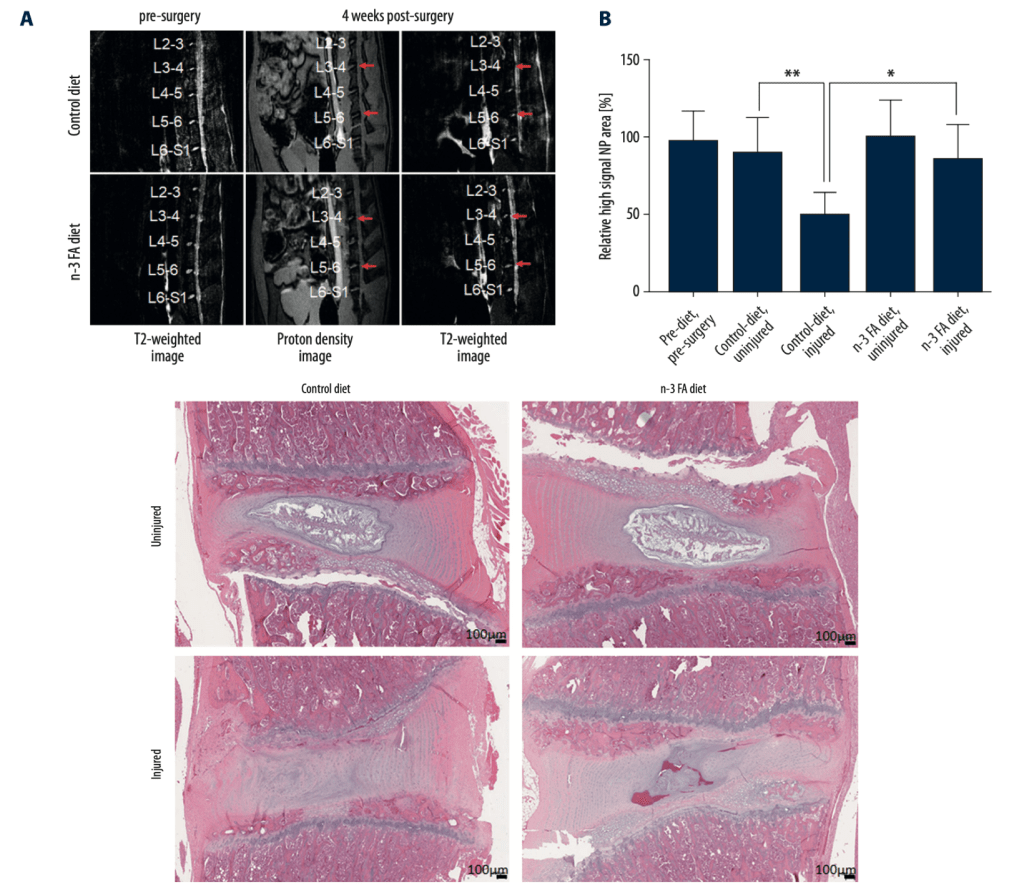
Con el omega 6 encontramos una doble función: favorecen la síntesis de lipoxinas a la vez que también lo hacen con sustancias inflamatorias (ej. leucotrienos: LTB4 y prostaglandinas: PGE2). Por tanto, ante una lesión quizá nos interesa más poner el foco en que haya una buena ingesta de omega 3. No es que el omega 6 no deba consumirse, pero la cantidad de estos ácidos grasos no debería ser muy superior a los de sus colegas con el número 3. De hecho el ratio resolvinas/leucotrienos (RvD1/LTB4) parece ser buen indicador del estado inflamatorio de una persona (Fattori et al., 2019). En función del equilibrio entres estos omegas 3 y 6 la regeneración de los tejidos puede ser muy diferente. La siguiente imagen lo ilustra muy bien.
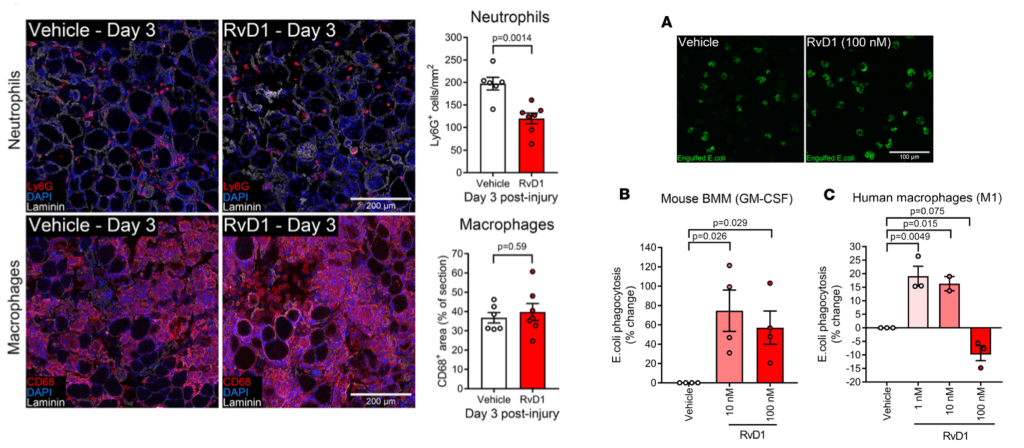
Omega 3 para resolver la inflamación y el dolor en humanos
En la sección anterior hemos visto numerosas investigaciones que apoyan el empleo de omega 3 como tratamiento coadyuvante en casos de lesión y dolor, pero son todos estudios hechos con roedores, ¿es extrapolable esto a nuestra especie? ¿qué pasa en el homo sapiens? Veamos…
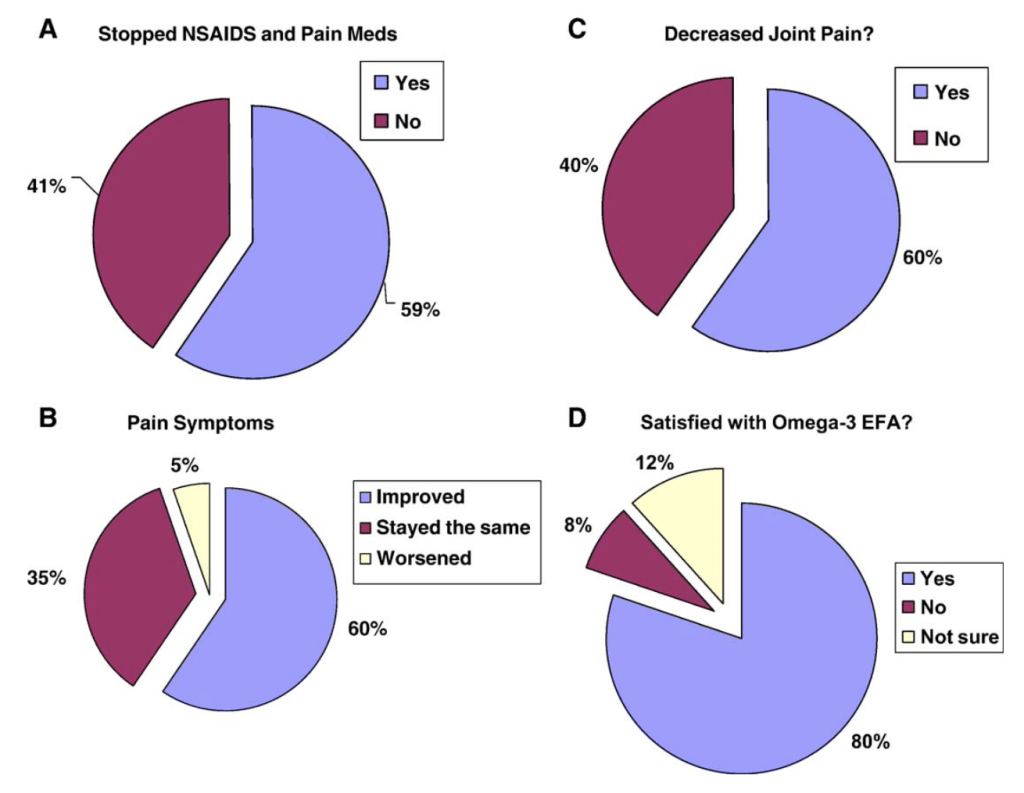
Uno et al. (2015) investigaron los efectos de tomar o no una suplementación enriquecida con omega 3 (EPA) una semana antes de una operación (resección hepatobiliar). Al ingerir esta dosis de omega 3 los niveles de SPMs (resolvina) en plasma aumentaron y los resultados logrados fueron muy positivos. Vieron que en ambos grupos de personas aumentaron marcadores inflamatorios y ocurrieron complicaciones postoperativas (ej. infección en herida, neumonía, sepsis…); no obstante, la inflamación y el porcentaje de personas con estas complicaciones, así como su severidad, fue sustancialmente menor en aquellos pacientes que tomaron la suplementación comentada (la tasa de complicaciones fue un ¡40% menor!). Lo que coincide con lo que ocurrió con el número de días hospitalizados: significativamente mayor en el grupo control (36.9 vs 53.9 días). En este sentido ya contamos con un metanálisis que muestra que las estrategias de inmunonutrición (donde se incluye omega 3) parecen ser efectivas para reducir infecciones y morbilidad postcirugía (Slim et al., 2022). Y, aunque una revisión más reciente concluye que estos efectos postoperatorios positivos son pequeños y que se necesitan más estudios con una metodología rigurosa, los datos son prometedores (Mohsen et al., 2023).
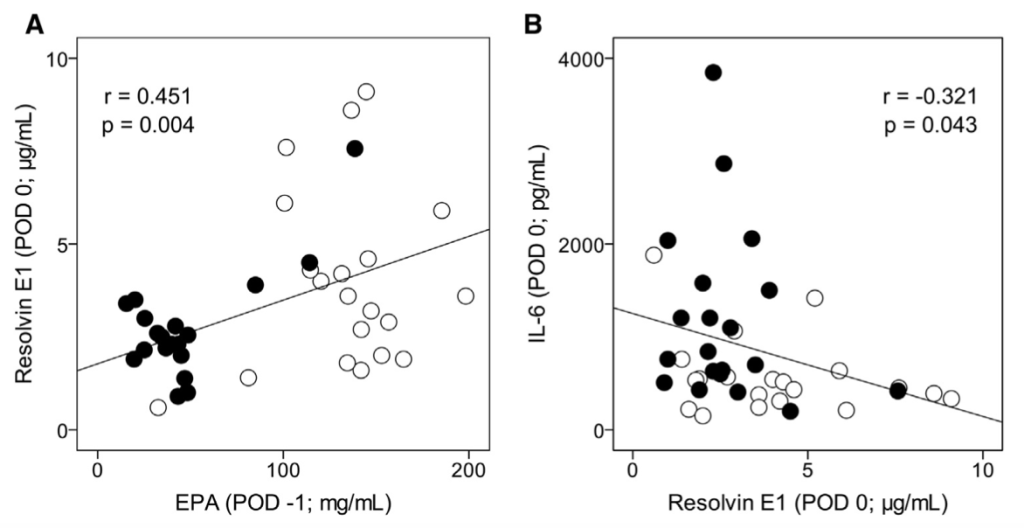
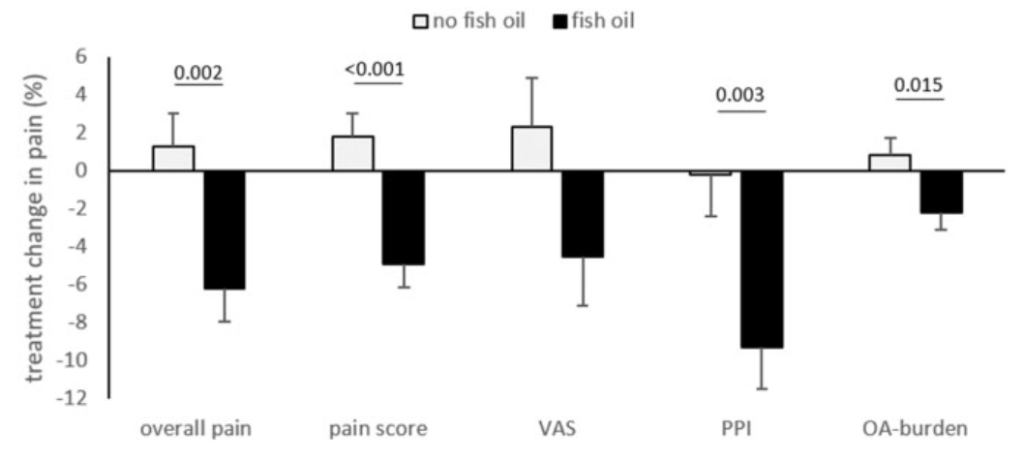
Además de esto, resaltaría la correlación encontrada entre los niveles de EPA en sangre con los de resolvinas (RvE1) y de estos últimos con los de IL-6 (inflamación); datos que podemos ver en la imagen de arriba, que ayudan a entender el porqué de los resultados comentados y que son similares a los arrojaron Barden et al., (2016). En esta investigación se encontró una correlación negativa entre los niveles de SPMs en plasma y líquido sinovial con la expresión de marcadores de inflamación (tasa de sedimentación eritrocítica) en personas con artritis —con inflamación no deseada por su duración— que habían ingerido una buena cantidad (2.4 g/día) de omega 3 durante 1 mes. Y lo que es más importante para estas personas: una relación, también negativa, entre los niveles de resolvina (RvE2) en líquido sinovial y el dolor percibido.
En un estudio más reciente (Kuszewski et al., 2020) demostraron que 16 semanas de suplementación con aceite de pescado (2.4 g/día; 400 mg EPA + 2000 mg DHA) en personas mayores con sobrepeso y con dolor persistente (que, también suelen presentar activas muchas células inflamatorias) redujo en un 40% la sintomatología y el nivel de impacto del dolor. Reducción que no se dio cuando se tomaba cúrcuma o placebo, y que fue significativamente mayor que en estos grupos.